Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1.
- 6. Горение серы в кислороде: Классификация химических реакций
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 8. Получение кислорода из перманганата калия: Классификация химических реакций
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
- 10. Взаимодействие натрия с водой: Классификация химических реакций
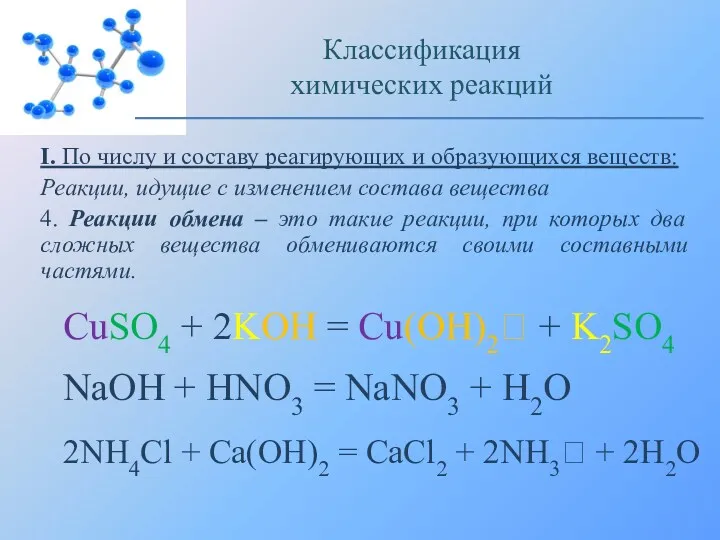
- 11. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
- 12. Получение аммиака из нашатыря Классификация химических реакций
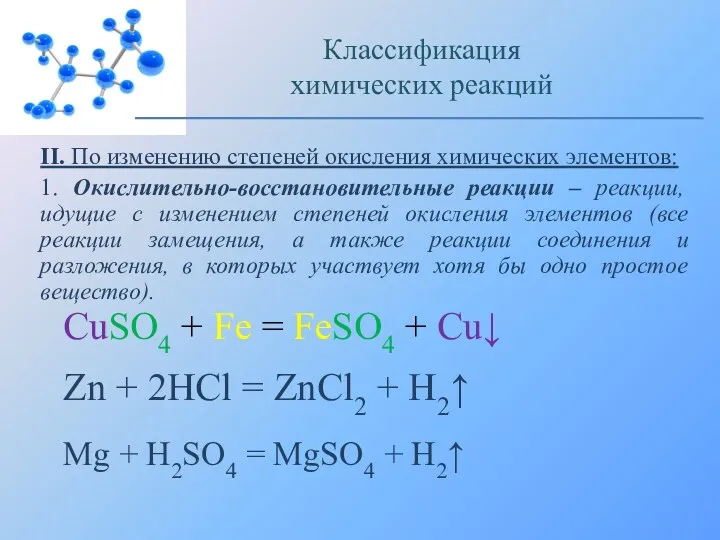
- 13. II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней
- 14. Взаимодействие железа с медным купоросом: Классификация химических реакций
- 15. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
- 16. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций
- 17. Разложение пероксида водорода: Классификация химических реакций
- 18. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
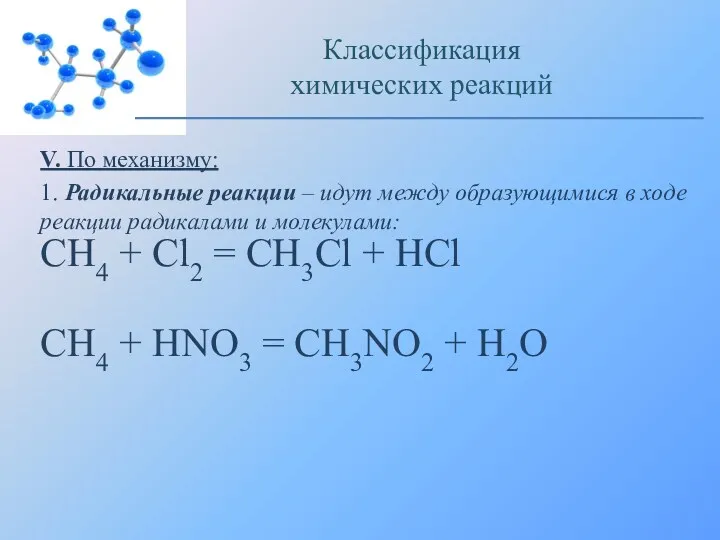
- 19. V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
- 20. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 21. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P +
- 22. Горение фосфора в кислороде: Классификация химических реакций
- 23. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 +
- 24. Разложение оксида ртути: Классификация химических реакций
- 25. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой
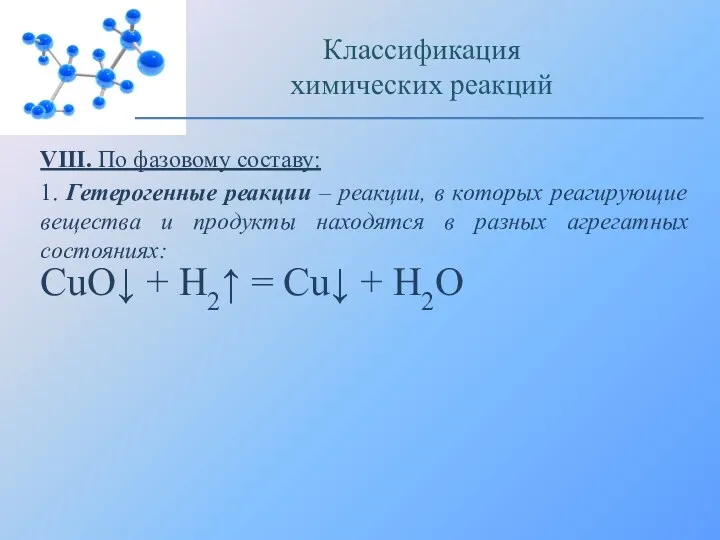
- 26. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 27. Восстановление оксида меди (II) водородом: Классификация химических реакций
- 29. Скачать презентацию






















 Физкультминутка Зима Диск
Физкультминутка Зима Диск Своя игра к интегрированному уроку по теме Творчество зарубежных поэтов
Своя игра к интегрированному уроку по теме Творчество зарубежных поэтов Памятные места Ивана Сергеевича Тургенева. Виртуальное путешествие
Памятные места Ивана Сергеевича Тургенева. Виртуальное путешествие суриков детство отрывок наизусть
суриков детство отрывок наизусть День православной книги
День православной книги Углеводороды. Природные источники углеводородов. Нефть, ее состав и переработка. Нефтепродукты. Бензин. Природный газ как топливо. Состав природного газа. 10 класс
Углеводороды. Природные источники углеводородов. Нефть, ее состав и переработка. Нефтепродукты. Бензин. Природный газ как топливо. Состав природного газа. 10 класс Инструментальные материалы в современном машиностроении. (Лекция 3)
Инструментальные материалы в современном машиностроении. (Лекция 3) Введение в направление подготовки. Управление: ключевые понятия
Введение в направление подготовки. Управление: ключевые понятия Строки, опаленные войной С.П. Гудзенко
Строки, опаленные войной С.П. Гудзенко Научно- исследовательская работа по теме: Календарные праздники и традиционная обрядность российских немцев Омского Прииртышья в сохранении календарной обрядности российскими немцами села Солнцевки Исилькульского района Омской области .
Научно- исследовательская работа по теме: Календарные праздники и традиционная обрядность российских немцев Омского Прииртышья в сохранении календарной обрядности российскими немцами села Солнцевки Исилькульского района Омской области . Амурская область
Амурская область Поздравляю с 23 февраля
Поздравляю с 23 февраля Порядок организации и осуществления подготовки различных групп населения в области гражданской обороны и защиты от ЧС
Порядок организации и осуществления подготовки различных групп населения в области гражданской обороны и защиты от ЧС Победа греков над персами в Марафонской битве
Победа греков над персами в Марафонской битве Mindset branding
Mindset branding Образовательный проект Моя инициатива в сфере образования
Образовательный проект Моя инициатива в сфере образования Части речи. Существительное
Части речи. Существительное Внеклассное чтение 12 - 14 лет
Внеклассное чтение 12 - 14 лет Ты помнишь, Тихвин, о войне. Хронология событий
Ты помнишь, Тихвин, о войне. Хронология событий Толерантность в ученических коллективах
Толерантность в ученических коллективах Установка умывальника с монтажом сифона и подключением к системе водоотведения
Установка умывальника с монтажом сифона и подключением к системе водоотведения Воспаление. Фазы воспалительной реакции
Воспаление. Фазы воспалительной реакции Одуванчики из салфеток
Одуванчики из салфеток Бизнес-план проекта. План менеджмента. (Лекция 11.3)
Бизнес-план проекта. План менеджмента. (Лекция 11.3) Географическое положение России. Тренажер 9 кл
Географическое положение России. Тренажер 9 кл Будущее простое время. Future simple tense
Будущее простое время. Future simple tense Эволюция государственного управления в Московском государстве во II половине XVI - XVII веков
Эволюция государственного управления в Московском государстве во II половине XVI - XVII веков Гигиенические требования к белью, комнатной одежде, одежде для прогулок и обуви детей первого года жизни
Гигиенические требования к белью, комнатной одежде, одежде для прогулок и обуви детей первого года жизни