Слайд 2

Слайд 3

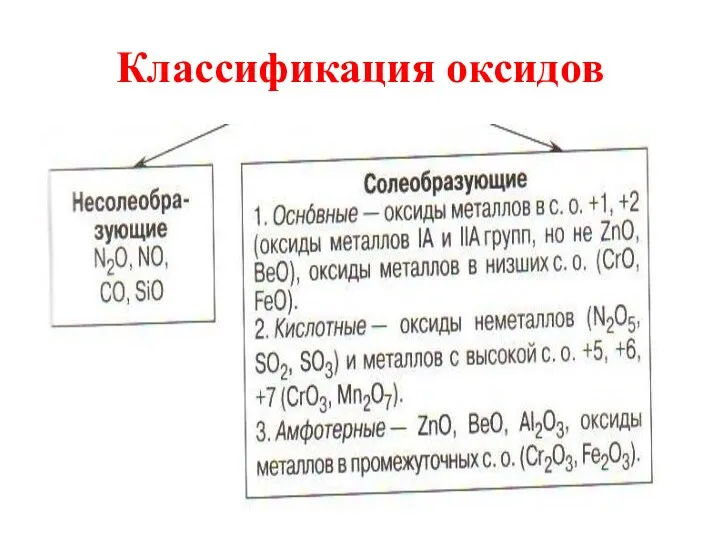
ОКСИДЫ
Оксиды- бинарные соединения с кислородом в степени окисления (-2).
Общая формула оксидов:
ЭmOn
где m число атомов элемента Э, а
n – число атомов кислорода.
Слайд 4
Слайд 5

Несолеобразующие оксиды
Несолеебразующими называются такие оксиды, которые не взаимодействуют ни со щелочами,
ни с кислотами и не образуют солей. Их немного, в их состав входят неметаллы.
Слайд 6

Солеобразующие
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и
образуют при этом соль и воду.
Среди солеобразующих оксидов различают оксиды: основные, кислотные, амфотерные.
Слайд 7

Основные оксиды
Основные оксиды - это такие оксиды, которым соответствуют основания. Например:
СаО - Са(ОН)2
Na2O - NaOH
Слайд 8

Кислотные оксиды
Кислотные оксиды - это такие оксиды, которым соответствуют кислоты.
Это оксиды
неметаллов:
N2O 5 соответствует Н NO 3 ,
SO3 – H2SO4
А так же оксиды металлов с большим значением степеней окисления:
Сr2 O3 - H2 Сr O4
Mn2O7 - H MnO4
Слайд 9

Амфотерные оксиды
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные
или кислотные свойства.
Это ZnO, Al2O3, Cr2O3, V2O3
Амфотерные оксиды с водой непосредственно не соединяются.








 Гемолитические анемии
Гемолитические анемии Метрологическая аттестация средств измерений
Метрологическая аттестация средств измерений My day (phrasal verb)
My day (phrasal verb)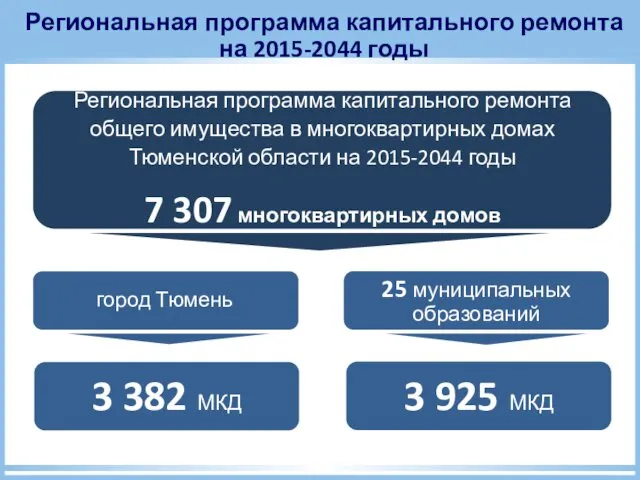 Региональная программа капитального ремонта на 2015-2044 годы
Региональная программа капитального ремонта на 2015-2044 годы Мастер-класс Народная обрядовая кукла.
Мастер-класс Народная обрядовая кукла. Prezentatsia
Prezentatsia Природные зоны Республики Татарстан (часть 2)
Природные зоны Республики Татарстан (часть 2) Нетрадиционные культы и секты
Нетрадиционные культы и секты Организация и проведение аварийно-спасательных и других неотложных работ
Организация и проведение аварийно-спасательных и других неотложных работ Лиса -рыжая краса (Как лиса научилась звук С произносить)
Лиса -рыжая краса (Как лиса научилась звук С произносить) Астраханский Кремль
Астраханский Кремль Работа со сказкой Теремок в младшей группе Диск Диск
Работа со сказкой Теремок в младшей группе Диск Диск Мотивирование независимого мониторинга уровня владения английским языком
Мотивирование независимого мониторинга уровня владения английским языком Влияние человека на природу Африки. Заповедники и национальные парки
Влияние человека на природу Африки. Заповедники и национальные парки Качество образовательного процесса
Качество образовательного процесса Игры - эстафеты
Игры - эстафеты Оружие массового поражения. Химическое оружие
Оружие массового поражения. Химическое оружие Құрылыстар жобасы, жоба жасауға қолданылатын нұсқаулар мен құжаттар
Құрылыстар жобасы, жоба жасауға қолданылатын нұсқаулар мен құжаттар Алгоритм поиска оптимальных параметров бурения
Алгоритм поиска оптимальных параметров бурения История. ЕГЭ. Первые русские князья
История. ЕГЭ. Первые русские князья Повышение качества образования в дошкольном учреждении через художественно-эстетическое воспитание детей.
Повышение качества образования в дошкольном учреждении через художественно-эстетическое воспитание детей. Мастер-класс Солнышко
Мастер-класс Солнышко Быт и нравы Древней Руси
Быт и нравы Древней Руси Методическая разработка по выполнению исследовательской работы в основной школе (5-7 классы)
Методическая разработка по выполнению исследовательской работы в основной школе (5-7 классы) урок Карбоновые кислоты
урок Карбоновые кислоты Учет денежных средств
Учет денежных средств Конституция РФ
Конституция РФ Судебно-медицинская экспертиза отравлений
Судебно-медицинская экспертиза отравлений