Содержание
- 2. Чтобы что-то узнать, Нужно уже, что-то знать. С. Лем
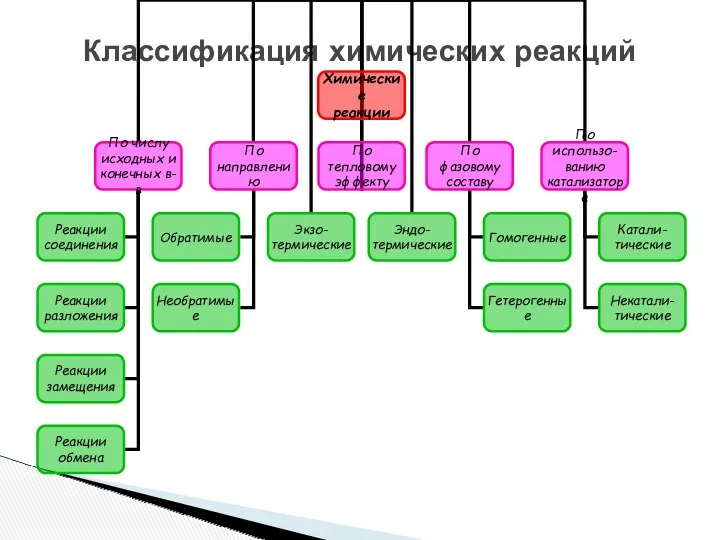
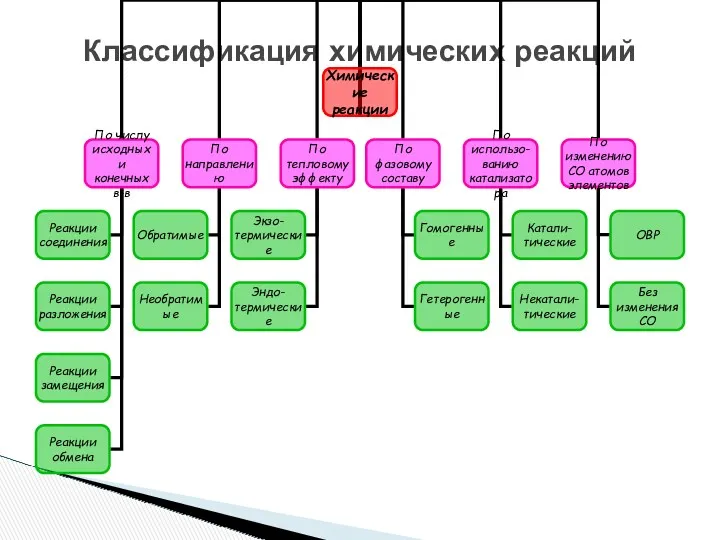
- 3. Классификация химических реакций
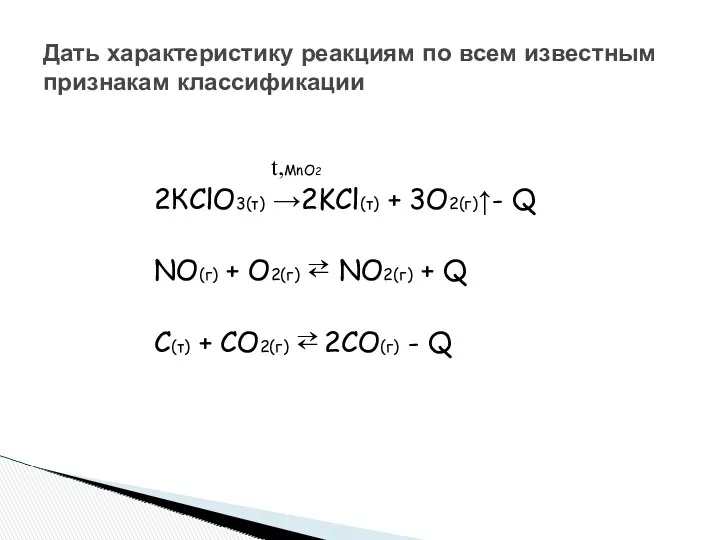
- 4. Дать характеристику реакциям по всем известным признакам классификации t,MnO2 2КClO3(т) →2KCl(т) + 3O2(г)↑- Q NO(г) +
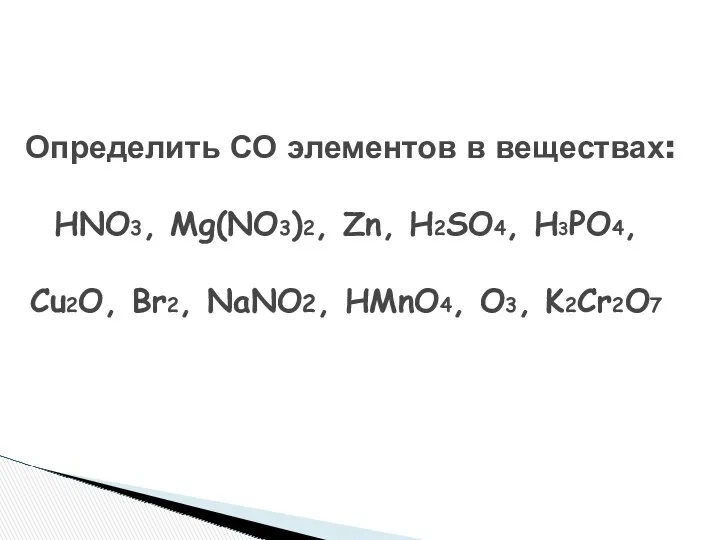
- 5. Определить СО элементов в веществах: HNO3, Mg(NO3)2, Zn, H2SO4, H3PO4, Cu2O, Br2, NaNO2, HMnO4, O3, K2Cr2O7
- 6. Цель проекта «Семь чудес России» – возрождение чувства патриотизма и любви к своему Отечеству, а также
- 7. «Семь чудес России»
- 8. «Семь чудес России»
- 9. «Семь чудес России»
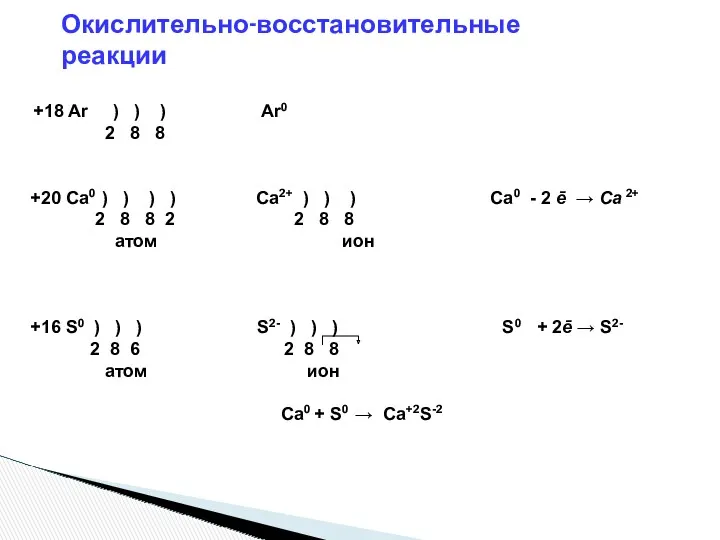
- 10. +18 Ar ) ) ) Ar0 2 8 8 +20 Ca0 ) ) ) ) Ca2+
- 11. Классификация химических реакций
- 12. ОВР – это такие реакции, при которых происходит изменение СО. Окисление – это процесс отдачи электронов,
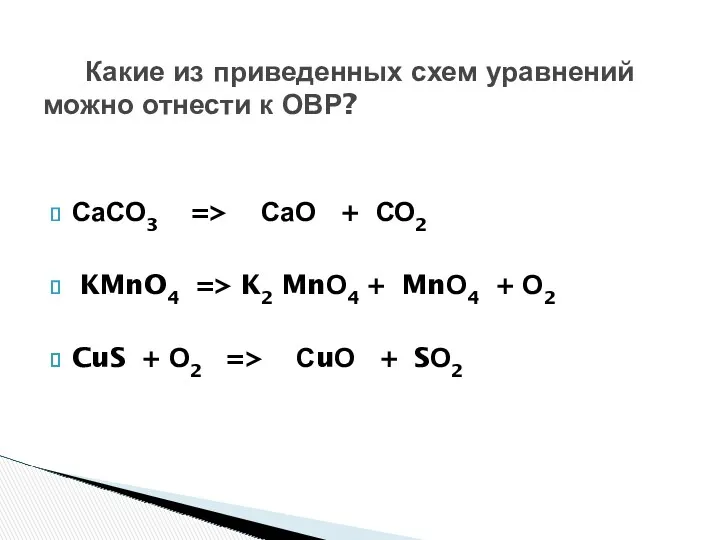
- 13. Какие из приведенных схем уравнений можно отнести к ОВР? СаСО3 => СаО + СО2 KMnO4 =>
- 14. Вывод: Окислительно-восстановительные процессы встречаются не только на уроках химии. Это и дыхание, и обмен веществ в
- 16. Скачать презентацию







 Родительское собрание для родителей выпускников.
Родительское собрание для родителей выпускников. Диагностика уровня тревожности в младшем школьном возрасте
Диагностика уровня тревожности в младшем школьном возрасте Логические основы цифровых устройств. Лекция 5
Логические основы цифровых устройств. Лекция 5 Овцеводство и козоводство
Овцеводство и козоводство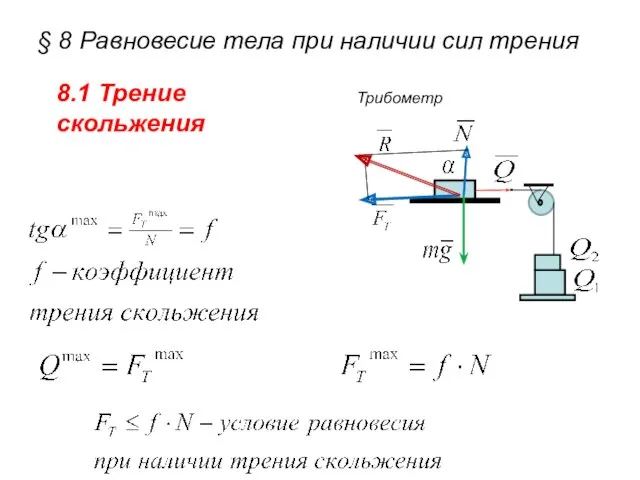 §8. Равновесие тела при наличии сил трения
§8. Равновесие тела при наличии сил трения Экологический фестиваль Заповедник времен
Экологический фестиваль Заповедник времен Теория поэтапного формирования умственных действий П.Я. Гальперина
Теория поэтапного формирования умственных действий П.Я. Гальперина Презентация к 8 марта.
Презентация к 8 марта.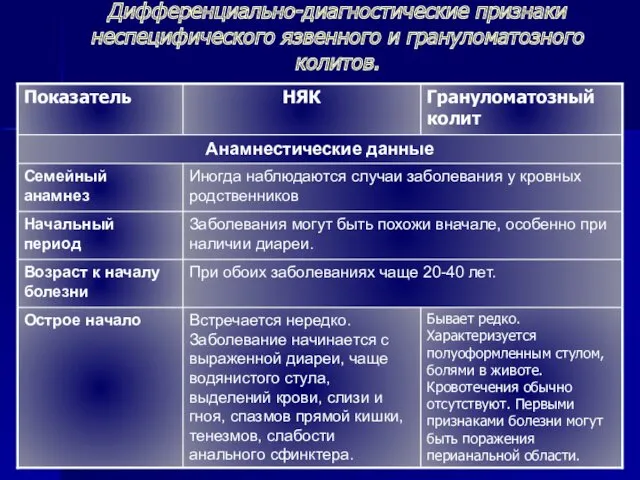 Дифференциально-диагностические признаки неспецифического язвенного и грануломатозного колитов
Дифференциально-диагностические признаки неспецифического язвенного и грануломатозного колитов Подготовка к ЕГЭ. Синтаксические нормы
Подготовка к ЕГЭ. Синтаксические нормы презентация техника безопасности
презентация техника безопасности Конкурс. Разновидности конкурсов
Конкурс. Разновидности конкурсов Чрезвычайные ситуации химического характера
Чрезвычайные ситуации химического характера Диагностика классного коллектива
Диагностика классного коллектива Современные требования к приемке выполненных работ. Конференция Асфальтобетон 2020 г. Санкт-Петербург
Современные требования к приемке выполненных работ. Конференция Асфальтобетон 2020 г. Санкт-Петербург Презентация к открытому занятию Гуси-Лебеди
Презентация к открытому занятию Гуси-Лебеди Борис Владимирович Заходер
Борис Владимирович Заходер Ислам. Основы веры, учения
Ислам. Основы веры, учения презентация антарктида
презентация антарктида презентация Формирование личности ребенка дошкольного возраста посредством эстетического воспитания при взаимодействии семьи и доу
презентация Формирование личности ребенка дошкольного возраста посредством эстетического воспитания при взаимодействии семьи и доу Путешествие по Солнечной системе. Решение уравнений
Путешествие по Солнечной системе. Решение уравнений bigger smaller
bigger smaller Международный день детей. Викторина
Международный день детей. Викторина Физиология пищеварения
Физиология пищеварения Чего себе не хочешь, того другим не делай.
Чего себе не хочешь, того другим не делай. Панно с маками.
Панно с маками.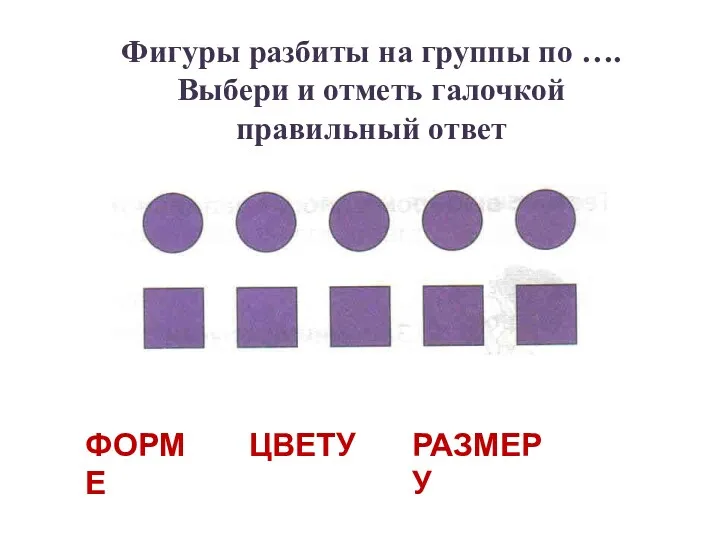 Презентация к занятию на тему: Классификация предметов по форме, цвету, размеру
Презентация к занятию на тему: Классификация предметов по форме, цвету, размеру Состояние травматизма в организациях Лысьвенского городского округа
Состояние травматизма в организациях Лысьвенского городского округа