Содержание
- 2. Одинокий жил металл, Гидроксогруппе дружбу предлагал И в любви признание, Это – основание !
- 3. А если серьезно ?
- 4. ОСНОВАНИЯ- это сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- 5. ГИДРОКСОГРУППА - это группа ОН , ее валентность I
- 6. В гидроксиде натрия атом натрия соединен с одной гидроксогруппой
- 7. ОСНОВАНИЯ– это ГИДРОКСИДЫ МЕТАЛЛОВ П р и м е р ы Гидроксид натрия – NaOH Гидроксид
- 8. Каковы формулы гидроксидов калия, бария и меди (II) ?
- 9. ОТВЕТЫ: Гидроксид калия – КОН Гидроксид бария - Ва (ОН)2 Гидроксид меди (II) – Cu (ОН)2
- 10. ЕСЛИ ТЫ ВЕРНО СОСТАВИЛ ФОРМУЛЫ, МО - ЛО - ДЕЦ ! А ЕСЛИ ТЫ ОШИБСЯ….
- 11. А если ты ошибся тут, Начинай сначала! Знай: число гидроксогрупп Равно валентности металла .
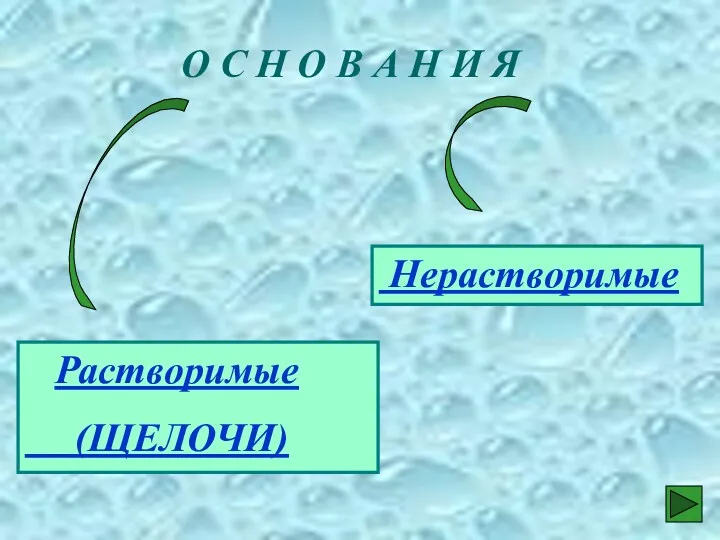
- 12. О С Н О В А Н И Я Растворимые (ЩЕЛОЧИ) Нерастворимые
- 13. СВОЙСТВА ЩЕЛОЧЕЙ
- 14. При растворении щелочей в воде выделяется тепло.Растворы щелочей «мылкие» на ощупь. Концентрированные растворы щелочей разрушают ткани
- 16. А теперь о химических свойствах ЩЕЛОЧЕЙ
- 17. В щелочах фиолетовый лакмус становится синим
- 18. В щелочах оранжевый метилоранж становится желтым
- 19. Но лучший индикатор для щелочей – это ФЕНОЛФТАЛЕИН, потому что он бесцветный в кислой и нейтральной
- 20. Попасть в кислоту Нету горше удачи… Но он перетерпит Без вздоха, без плача. Зато в щелочах
- 21. Основное взаимодействует с кислотным, П О Э Т О М У…….
- 22. Щелочи (основания) взаимодействуют с кислотами и кислотными оксидами. NaOH +HCl = Ba(OH)2 + CO2 = При
- 23. СВОЙСТВА нерастворимых оснований
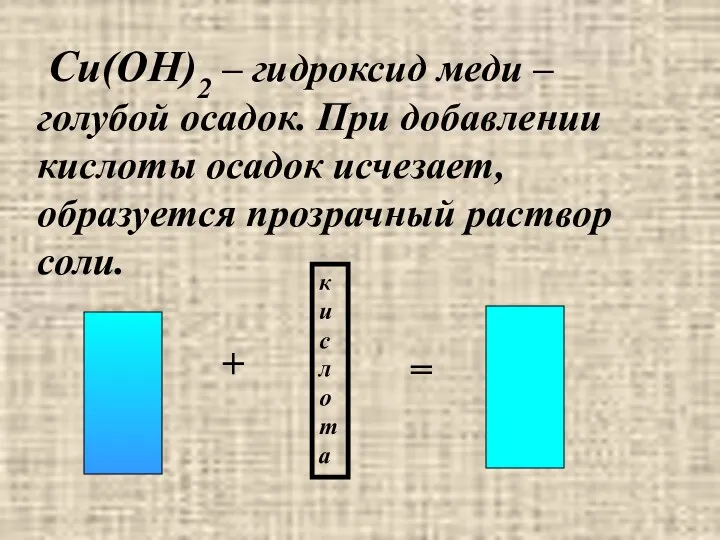
- 24. Cu(OH)2 – гидроксид меди – голубой осадок. При добавлении кислоты осадок исчезает, образуется прозрачный раствор соли.
- 25. Следовательно, нерастворимые основания взаимодействуют с кислотами с образованием соли и воды. Cu(OH)2 + H2SO4 = CuSO4
- 27. Скачать презентацию






















 Конспект урока и презентация Почитай родителей
Конспект урока и презентация Почитай родителей Заболевания печени
Заболевания печени Тревожные дети тревожных родителей
Тревожные дети тревожных родителей Ароматерапія – медицина майбутнього
Ароматерапія – медицина майбутнього Становление христианства и развитие больничного дела
Становление христианства и развитие больничного дела Логопедическая работа с учащимися 1 классов.
Логопедическая работа с учащимися 1 классов. Работа ученицы Первая железная дорога
Работа ученицы Первая железная дорога Элементы дизайна
Элементы дизайна Методы обеспечения финансовой безопасности предприятий отрасли дорожного строительства
Методы обеспечения финансовой безопасности предприятий отрасли дорожного строительства заявка на семинар
заявка на семинар Будь осторожен с огнём!
Будь осторожен с огнём! Culture and International Public Relations
Culture and International Public Relations Комплексные методы управления качеством
Комплексные методы управления качеством Бюджет МО Южно-Приморский на 2019 год и плановый период 2020 и 2021 годов
Бюджет МО Южно-Приморский на 2019 год и плановый период 2020 и 2021 годов Ряд Фурье и интеграл Фурье
Ряд Фурье и интеграл Фурье Шаблон. Руководство по использованию фирменного стиля администрации города Ноябрьска
Шаблон. Руководство по использованию фирменного стиля администрации города Ноябрьска Телефон доверия для детей и подростков, и их родителей
Телефон доверия для детей и подростков, и их родителей Робототехника в нашей жизни
Робототехника в нашей жизни sohrani_moyu_i_svoyu_zhizn
sohrani_moyu_i_svoyu_zhizn Выводы логики высказываний (2)
Выводы логики высказываний (2) Составляющие и функции операционной системы Linux
Составляющие и функции операционной системы Linux золотая хохлома
золотая хохлома Перекрытия и полы малоэтажных зданий
Перекрытия и полы малоэтажных зданий Поздравление с Днем рождения
Поздравление с Днем рождения Единицы времени 2. Календарь. 2 класс
Единицы времени 2. Календарь. 2 класс Круглый стол на тему Наркомания и СПИД: сущность и проблема (методика проведения вебинара)
Круглый стол на тему Наркомания и СПИД: сущность и проблема (методика проведения вебинара) Термообработка деревянного реквизита
Термообработка деревянного реквизита Характеристики позиционных систем счисления
Характеристики позиционных систем счисления