Содержание
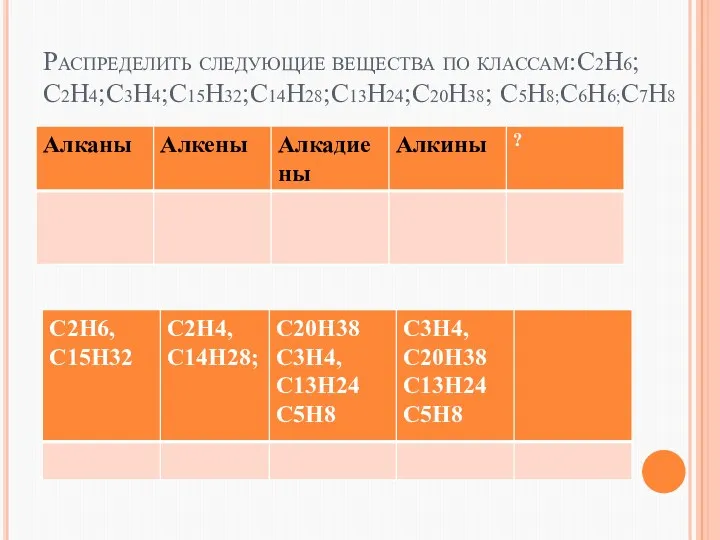
- 2. Распределить следующие вещества по классам:С2Н6;С2Н4;С3Н4;С15Н32;С14Н28;С13Н24;С20Н38; С5Н8;С6Н6;С7Н8
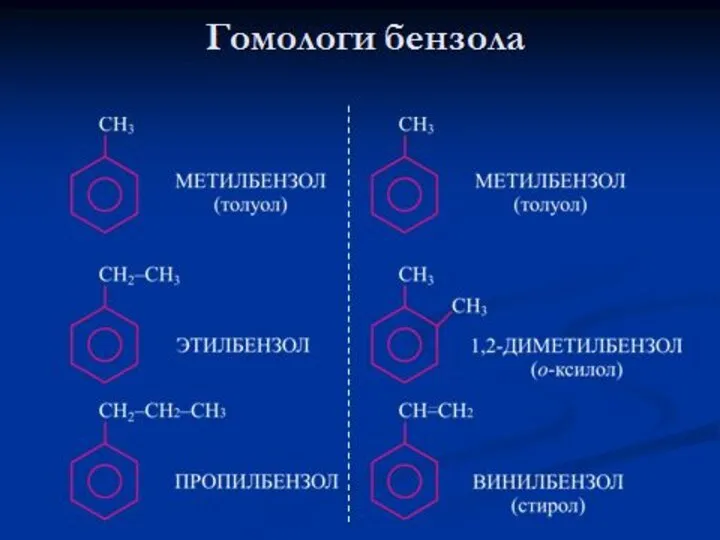
- 3. Общая формула углеводородов ряда бензола: CnH2n-6 где n=6,7,8,9,10…. т.е. n ≥ 6
- 4. Общая характеристика класса: Ароматическими углеводородами называются соединения, молекулы которых содержат устойчивые циклические структуры- бензольные ядра Термин
- 5. История открытия Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году
- 6. Второе рождение Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году
- 7. Новое получение В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли
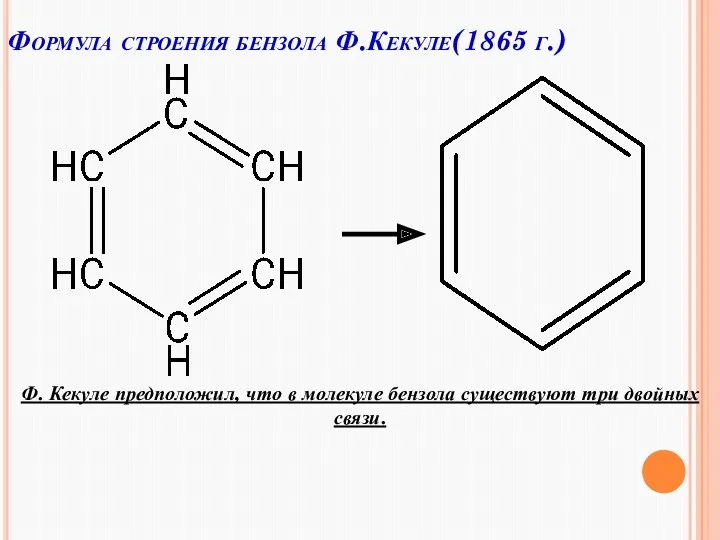
- 9. Формула строения бензола Ф.Кекуле(1865 г.) Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
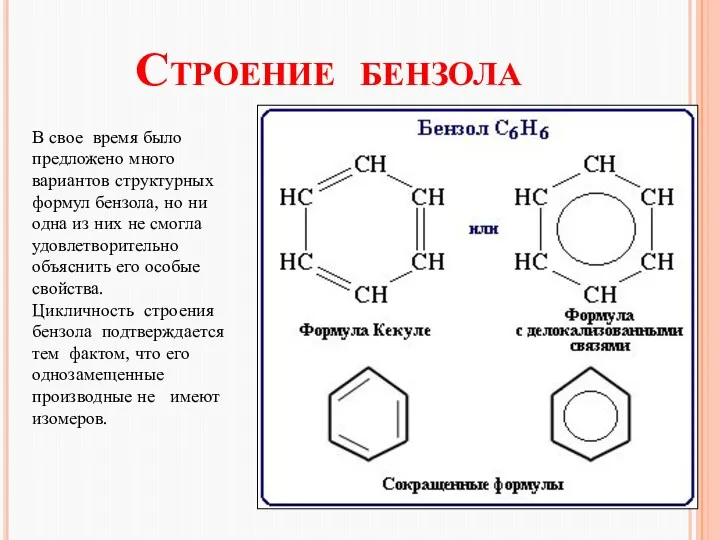
- 10. Строение бензола В свое время было предложено много вариантов структурных формул бензола, но ни одна из
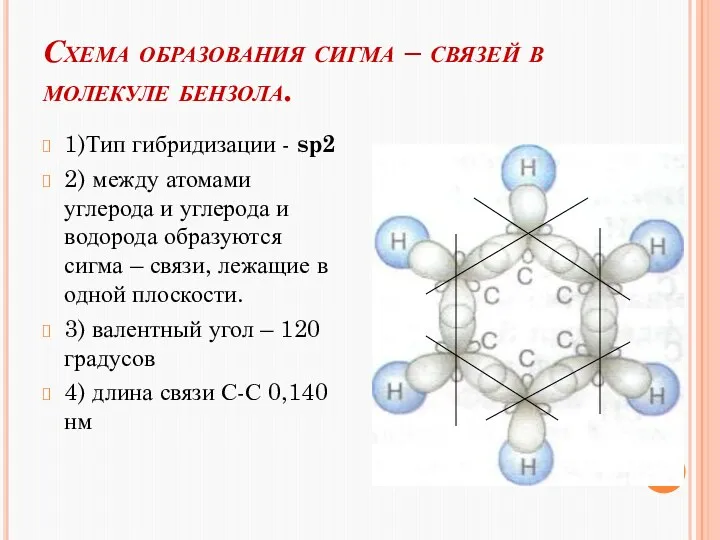
- 11. Схема образования сигма – связей в молекуле бензола. 1)Тип гибридизации - sр2 2) между атомами углерода
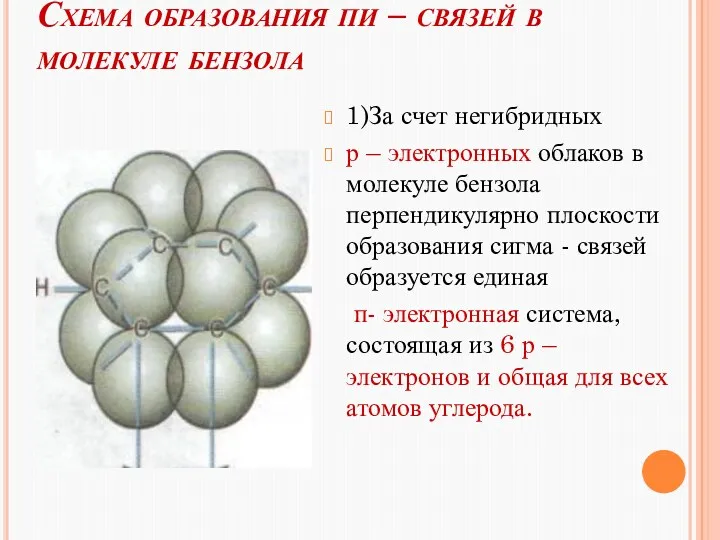
- 12. Схема образования пи – связей в молекуле бензола 1)За счет негибридных р – электронных облаков в
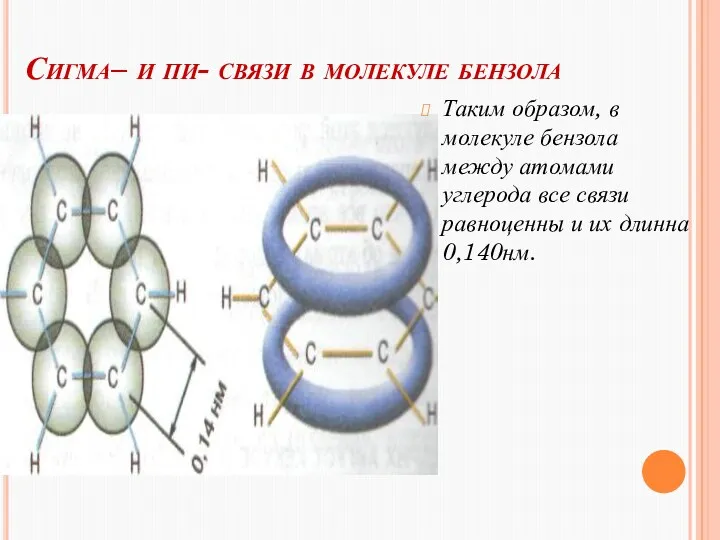
- 13. Сигма– и пи- связи в молекуле бензола Таким образом, в молекуле бензола между атомами углерода все
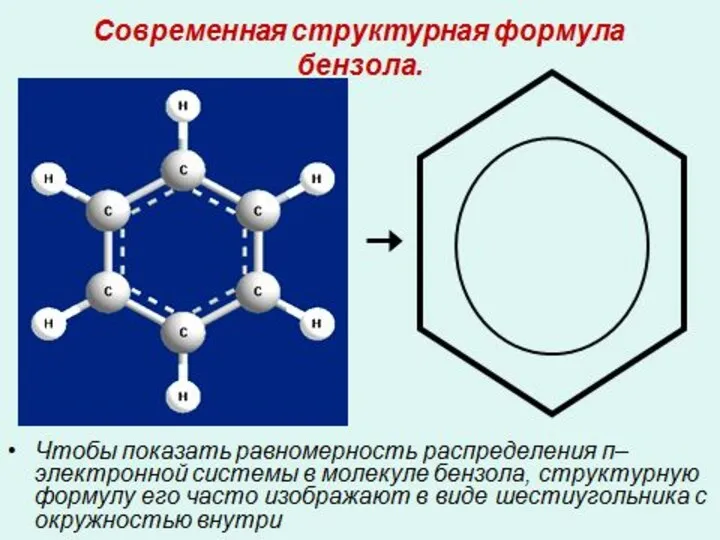
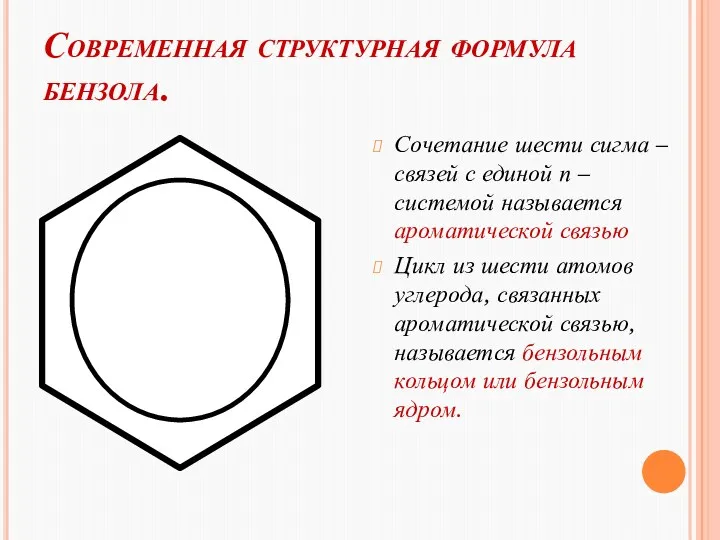
- 15. Современная структурная формула бензола. Сочетание шести сигма – связей с единой п – системой называется ароматической
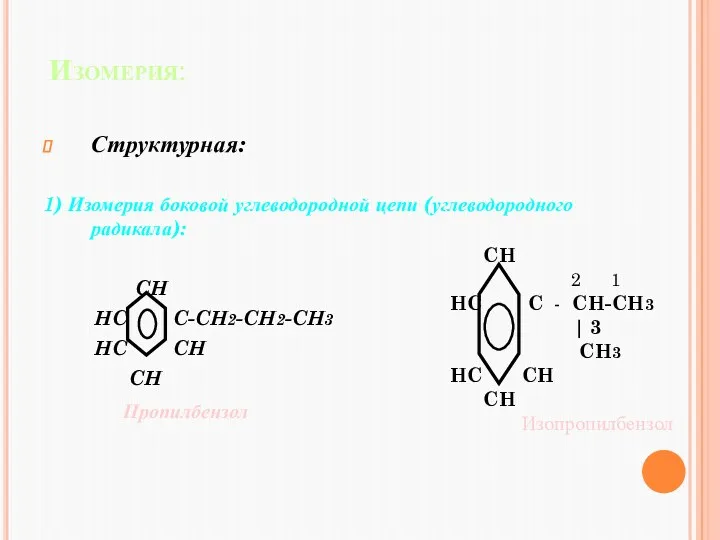
- 17. Изомерия: Структурная: 1) Изомерия боковой углеводородной цепи (углеводородного радикала): CH HC C-CH2-CH2-CH3 HC CH CH Пропилбензол
- 18. 2) Изомерия по количеству радикалов заместителей. CH CH HC C-СH2-CH3 HC C-CH3 HC CH HC C-CH3
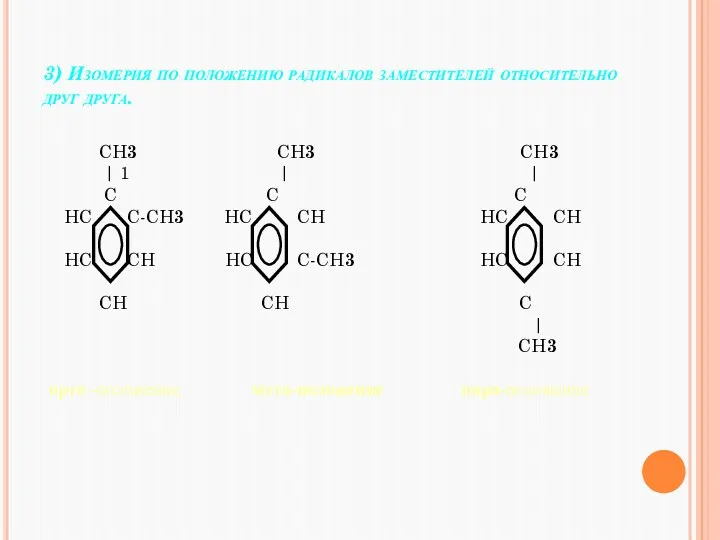
- 19. 3) Изомерия по положению радикалов заместителей относительно друг друга. CH3 CH3 CH3 | 1 | |
- 20. Получение Бензол получают из каменноугольной смолы, образующейся при коксовании угля. В настоящее время бензол получают из
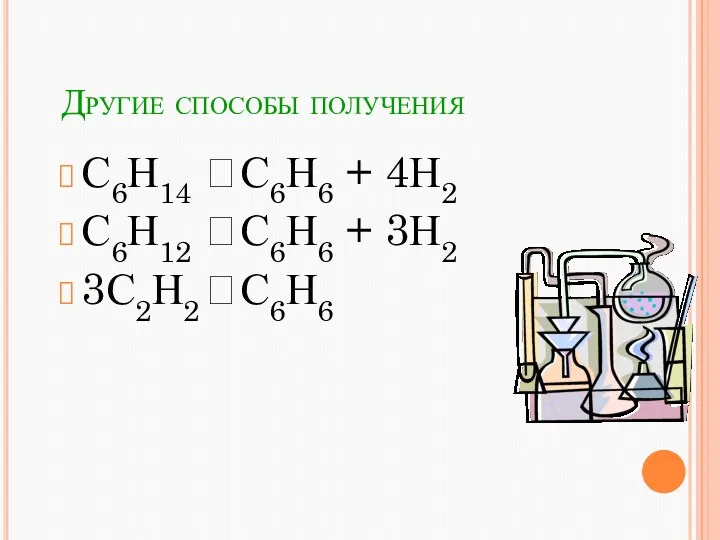
- 21. Другие способы получения С6Н14 С6Н6 + 4Н2 С6Н12 С6Н6 + 3Н2 3С2Н2 С6Н6
- 22. Физические свойства ароматических углеводородов: Ароматические углеводороды представляют собой жидкости или твердые вещества с характерным запахом. Углеводороды,
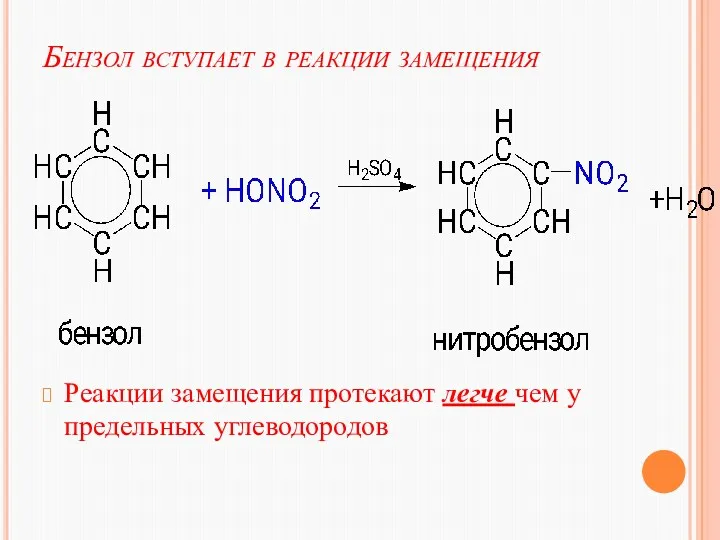
- 23. Бензол вступает в реакции замещения Реакции замещения протекают легче чем у предельных углеводородов
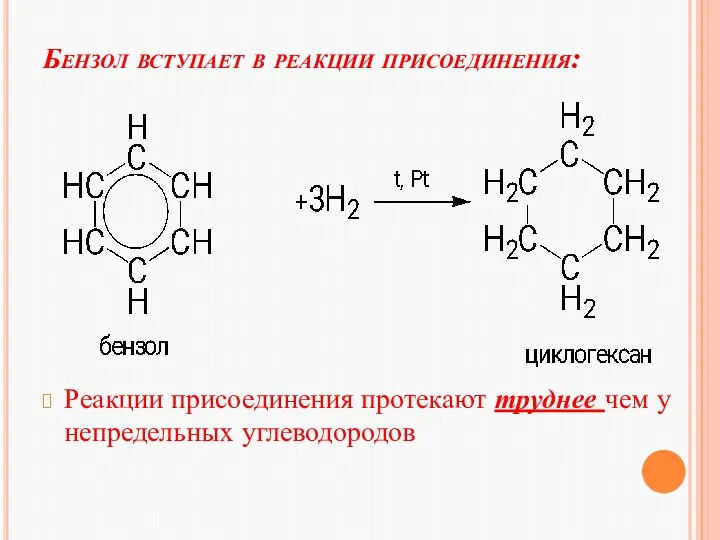
- 24. Бензол вступает в реакции присоединения: Реакции присоединения протекают труднее чем у непредельных углеводородов
- 25. Химические свойства 1.Горение бензола: 2С6Н6 + 15О2 = 12СО2 + 6Н2О 2. Реакция замещения: С6Н6 +
- 27. Скачать презентацию










 Матрешки. Виды матрешек
Матрешки. Виды матрешек Simatic S7
Simatic S7 Гуманитариум. Вопросы трудоустройства выпускников гуманитарных специальностей
Гуманитариум. Вопросы трудоустройства выпускников гуманитарных специальностей 20230626_summa_arifmeticheskoy_progressii
20230626_summa_arifmeticheskoy_progressii Введение в робототехнику
Введение в робототехнику Стандартные образцы в цветной металлургии
Стандартные образцы в цветной металлургии Презентация День Героев Отечества
Презентация День Героев Отечества организация проектной и исследовательской деятельности школьников в разных возрастных группах в условиях реализации современных образовательных стандартов.
организация проектной и исследовательской деятельности школьников в разных возрастных группах в условиях реализации современных образовательных стандартов. Гельминты в почве. Аскаридоз
Гельминты в почве. Аскаридоз Древняя Русь IX-XII вв.: генезис и специфика феодальных отношений
Древняя Русь IX-XII вв.: генезис и специфика феодальных отношений Калькулятор. Принцип работі
Калькулятор. Принцип работі Автоматическая стабилизация и управление углом тангажа
Автоматическая стабилизация и управление углом тангажа Множество и его элементы
Множество и его элементы Рисуем Прелюдию до мажор I том ХТК. 5 класс
Рисуем Прелюдию до мажор I том ХТК. 5 класс Вспомогательные здания и сооружения
Вспомогательные здания и сооружения Основы работы в Naumen Service Desk Почты России
Основы работы в Naumen Service Desk Почты России Алкалоиды и их классификация
Алкалоиды и их классификация Отчёт по производственной электромонтажной практике
Отчёт по производственной электромонтажной практике Информационная безопасность. Комплексная модель безопасности. (Лекция 14)
Информационная безопасность. Комплексная модель безопасности. (Лекция 14) Учимся рисовать. Воробей, цапля
Учимся рисовать. Воробей, цапля Лекция № 10. Элементы релятивистской механики
Лекция № 10. Элементы релятивистской механики Ваш ребенок пятиклассник
Ваш ребенок пятиклассник Обеспечение режимов работы усилительных каскадов на транзисторах (лекция 3)
Обеспечение режимов работы усилительных каскадов на транзисторах (лекция 3) Массивы. Сортировки
Массивы. Сортировки 1654847282750884
1654847282750884 Общий обзор организма человека
Общий обзор организма человека Методология педагогической науки
Методология педагогической науки Проект Ой вы, птицы, к нам летите, весну красную несите!
Проект Ой вы, птицы, к нам летите, весну красную несите!