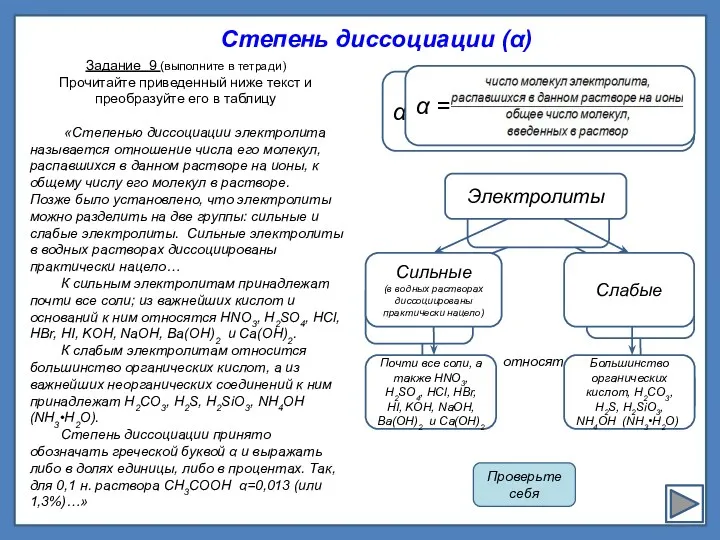
α = ------------------------------
Степень диссоциации (α)
«Степенью диссоциации электролита называется отношение
числа его молекул,
распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически нацело…
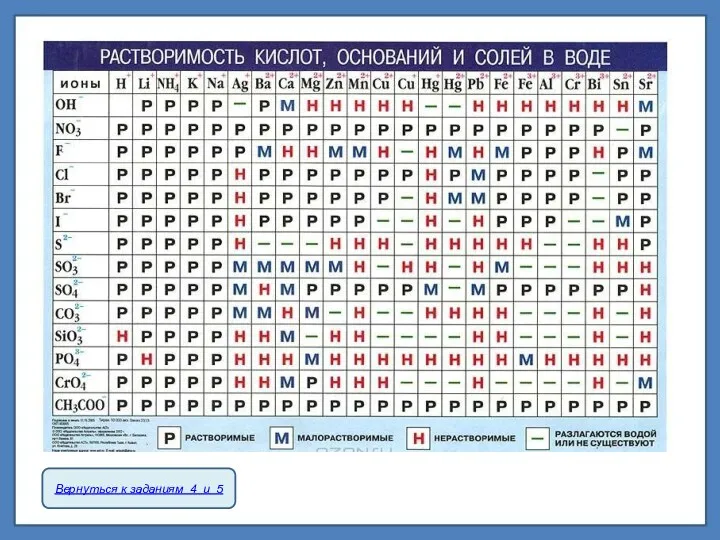
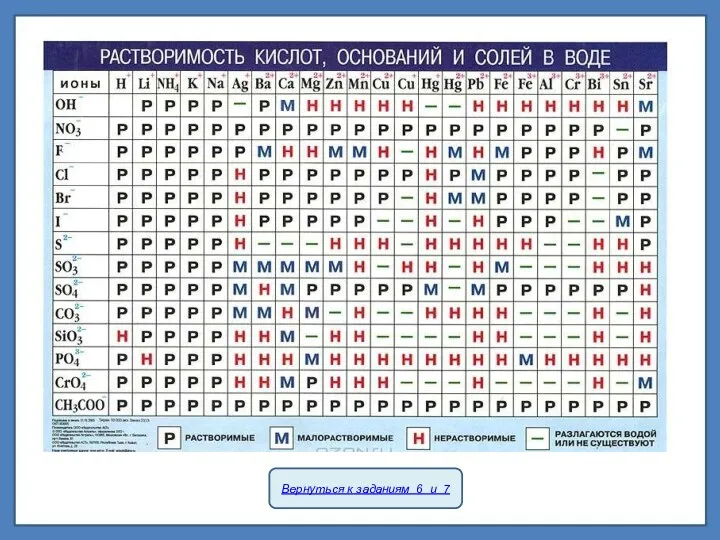
К сильным электролитам принадлежат почти все соли; из важнейших кислот и оснований к ним относятся HNO3, H2SO4, HCl, HBr, HI, KOH, NaOH, Ba(OH)2 и Ca(OH)2.
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СО3, H2S, H2SiO3, NH4OH (NH3•H2O).
Степень диссоциации принято обозначать греческой буквой α и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора СН3СООН α=0,013 (или 1,3%)…»
Задание 9 (выполните в тетради)
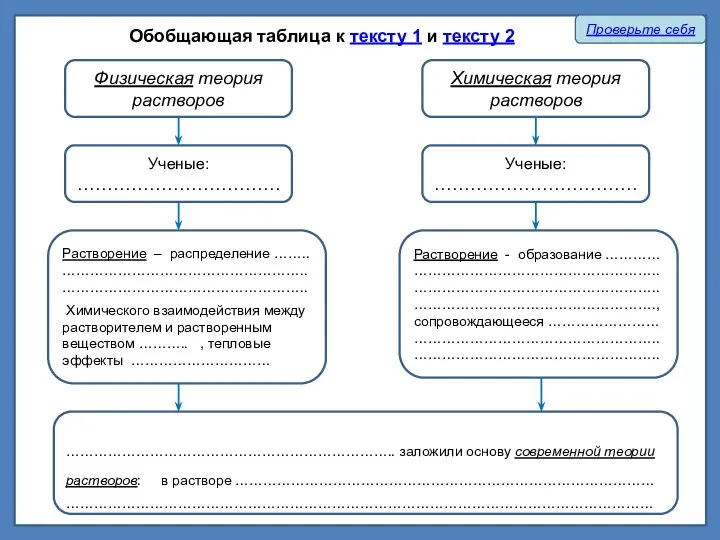
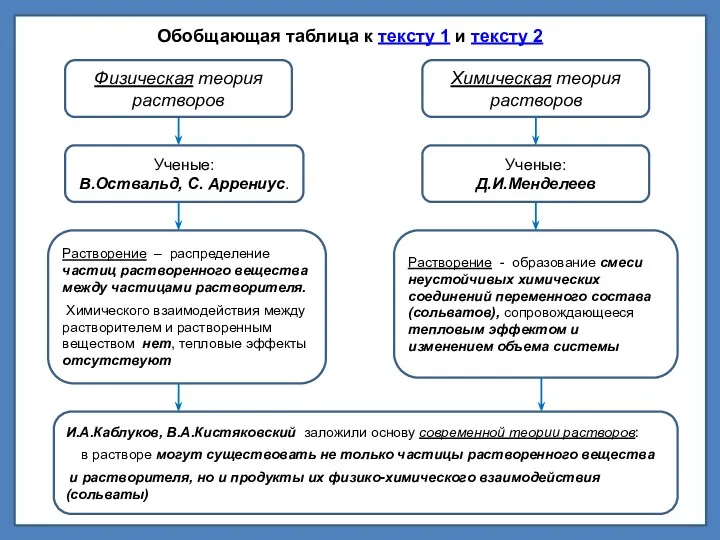
Прочитайте приведенный ниже текст и преобразуйте его в таблицу
относят
Проверьте себя






 Многообразие живого мира. Уровни организации живой материи
Многообразие живого мира. Уровни организации живой материи Какую роль играет религия в жизни современного российского общества
Какую роль играет религия в жизни современного российского общества Презентация о школе
Презентация о школе Практическая работа Получение уксусной кислоты и опыты с ней
Практическая работа Получение уксусной кислоты и опыты с ней Изображение рельефа на плане местности
Изображение рельефа на плане местности Мировая религия пастафарианство
Мировая религия пастафарианство Презентация по бисероплетению
Презентация по бисероплетению как подготовить и провести интегрированный урок
как подготовить и провести интегрированный урок Презентация Згоднев
Презентация Згоднев Базовые понятия реляционных баз данных. Лекция 6
Базовые понятия реляционных баз данных. Лекция 6 Олимпийские игры От древности до современности
Олимпийские игры От древности до современности Понятие, функции, виды религии
Понятие, функции, виды религии Презентация по методической теме: Балаларда туган җиребезгә мәхәббәт, аның табигатенә карата сакчыл караш тәрбияләү һәм экологик тәрбия бирү 2011-2015 год
Презентация по методической теме: Балаларда туган җиребезгә мәхәббәт, аның табигатенә карата сакчыл караш тәрбияләү һәм экологик тәрбия бирү 2011-2015 год : Вежливость.
: Вежливость. Портфолио модели и фотографа
Портфолио модели и фотографа Прекрасные дамы Елизаветинского времени. Елизавета I и другие
Прекрасные дамы Елизаветинского времени. Елизавета I и другие Основы исторического знания
Основы исторического знания Театральные профессии
Театральные профессии Переодические и непериодические бесконечные десятичные дроби
Переодические и непериодические бесконечные десятичные дроби История метода проектов в педагогике
История метода проектов в педагогике Трансплантология - создаем нового человека
Трансплантология - создаем нового человека Тайна бумажного листа
Тайна бумажного листа Палеография эпохи феодализма
Палеография эпохи феодализма План выполнения Ремонтной программы ООО Газпром теплоэнерго наименование ДО на 2021 год
План выполнения Ремонтной программы ООО Газпром теплоэнерго наименование ДО на 2021 год Основы религиозных культур и светской этики. Родительское собрание
Основы религиозных культур и светской этики. Родительское собрание Веселый мир Оригами - презентация
Веселый мир Оригами - презентация Терехин. Герой без Золотой звезды!
Терехин. Герой без Золотой звезды! Разложение по переменным. ДМ 2. ДНФ и КНФ
Разложение по переменным. ДМ 2. ДНФ и КНФ