Содержание
- 2. Цель Сформировать понятие о кислотах как классе электролитов; Рассмотреть их классификацию по разным признакам; Представить химические
- 3. Что такое кислоты? Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с
- 4. Классификация кислот
- 5. Химические свойства кислот Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с
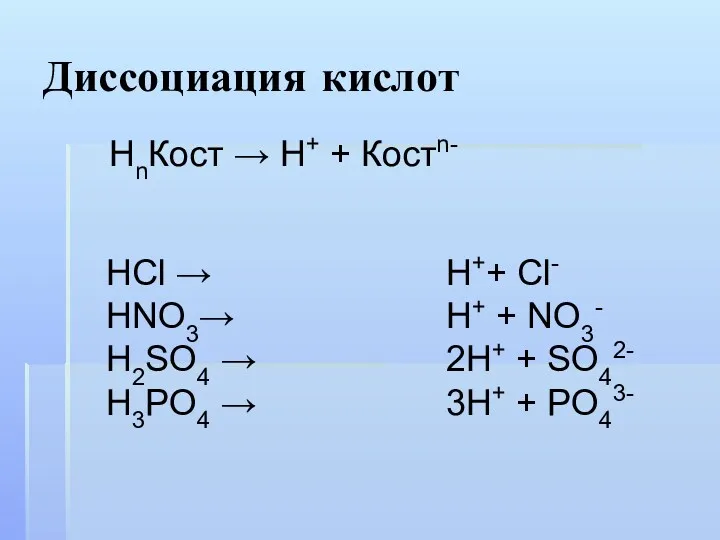
- 6. Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl-
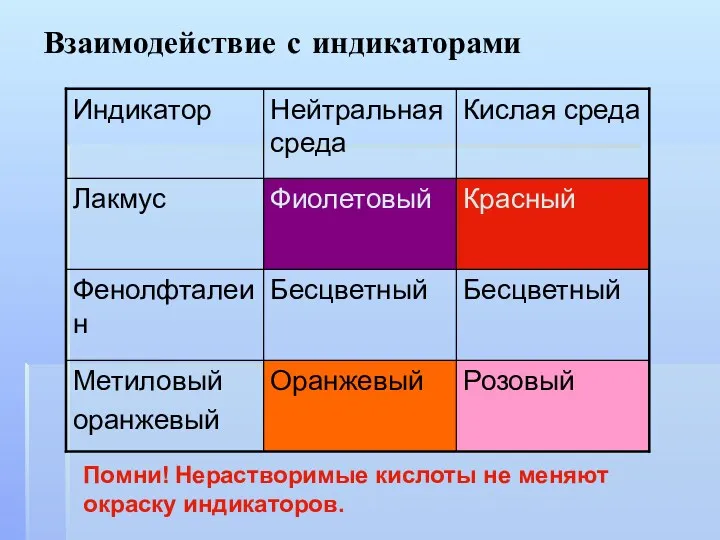
- 7. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов.
- 8. Взаимодействие с металлами Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al
- 9. Взаимодействие с основными оксидами МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота →
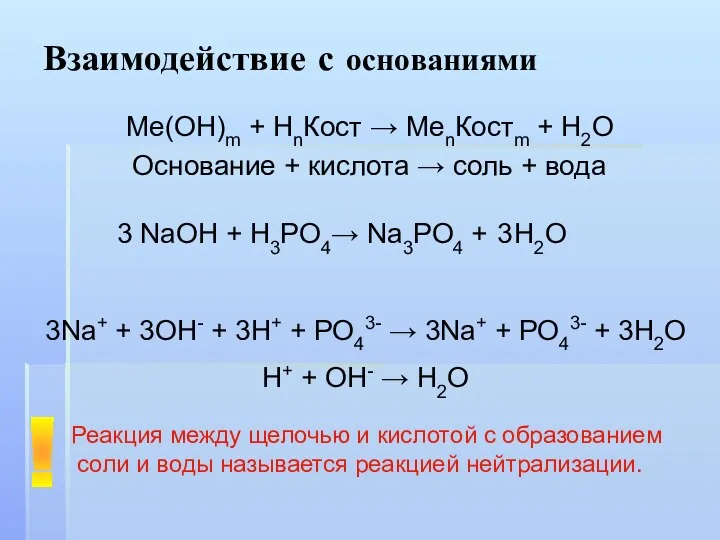
- 10. Взаимодействие с основаниями Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль +
- 11. Взаимодействие с солями МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота
- 13. Скачать презентацию







 Презентация Счастливый случай. Диск
Презентация Счастливый случай. Диск Арабский халифат и его распад
Арабский халифат и его распад Техногенная безопасность. Структура правовой системы в области обеспечения техногенной безопасности
Техногенная безопасность. Структура правовой системы в области обеспечения техногенной безопасности Поражения легких при системных заболеваниях
Поражения легких при системных заболеваниях web1
web1 Презентация Техника речи
Презентация Техника речи Программа поддержки местных инициатив на территории сельского поселения Уразовский сельсовет
Программа поддержки местных инициатив на территории сельского поселения Уразовский сельсовет презентация ко Дню матери
презентация ко Дню матери Проектирование первого этапа строительства мусоросортировочного комплекса мощностью до 150 000 тонн твердых коммунальных отходов
Проектирование первого этапа строительства мусоросортировочного комплекса мощностью до 150 000 тонн твердых коммунальных отходов Простая линейная регрессия. Регрессионный анализ
Простая линейная регрессия. Регрессионный анализ Виды трубопроводов
Виды трубопроводов разработка урока по теме Соли
разработка урока по теме Соли Образовательная и просветительская деятельность Русской Православной Церкви
Образовательная и просветительская деятельность Русской Православной Церкви Нововведения в кадастровой деятельности
Нововведения в кадастровой деятельности Путешествие в театр
Путешествие в театр презентация Неизвестный солдат
презентация Неизвестный солдат Презентация Пришкольный участок
Презентация Пришкольный участок Вулканы и Землетрясения
Вулканы и Землетрясения Боль и обезболивание
Боль и обезболивание Методическое портфолио победителя школьного этапа конкурса Учитель года -2015 Сибгатуллиной Р.И.
Методическое портфолио победителя школьного этапа конкурса Учитель года -2015 Сибгатуллиной Р.И. Sukhanov (1)
Sukhanov (1) Admissions statistics on undergraduate programs
Admissions statistics on undergraduate programs Безопасное лето
Безопасное лето Кетоацидоздық кома
Кетоацидоздық кома 20230829_kak_otkryt_zakrytye_dveri
20230829_kak_otkryt_zakrytye_dveri TY игрушки
TY игрушки ФГОС для родителей
ФГОС для родителей Сравнение чисел. 6 класс
Сравнение чисел. 6 класс