Содержание
- 2. Отметьте верное высказывание: 1) оксиды – это не бинарные соединения; 2) в щелочной среде лакмус имеет
- 3. ВОДОРОД В П Р И Р О Д Е H 1 1 , 0 0 7
- 4. Земная кора (массовая доля) 1 % 99 %
- 5. В составе атмосферного воздуха присутствие водорода менее 0,0001 %
- 6. На долю водорода приходится 50 % массы Солнца и других звезд
- 7. Распространение на Земле. Вода – Н2О Метан - CH4 Сероводород- H2S
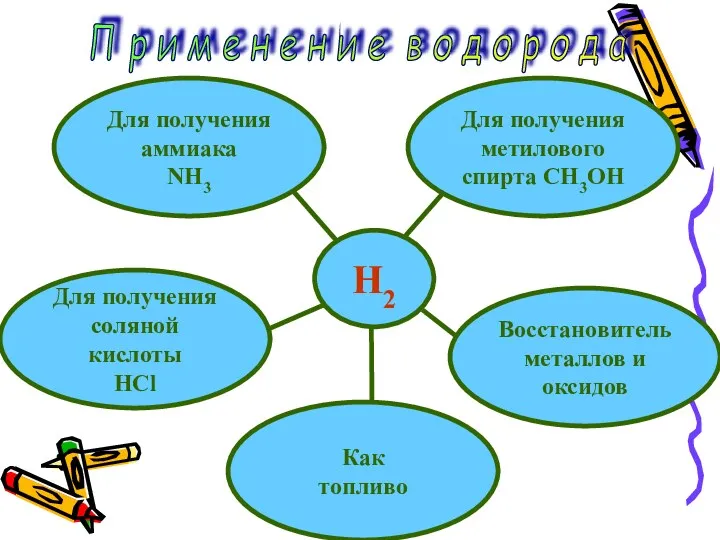
- 8. H2 Для получения аммиака NH3 Восстановитель металлов и оксидов Для получения соляной кислоты HCl Как топливо
- 9. Андрей Дмитриевич Сахаров 21 мая 1921 г. – 14 декабря 1989 г. водородная бомба. ядерный взрыв.
- 10. Какое соединение богаче водородом: H2O или CH 4 ? РЕШЕНИЕ:
- 11. Получение водорода В лаборатории: Взаимодействие цинка с соляной кислотой: Zn+2H Cl=ZnCl2+ H2 Взаимодействие калия с водой:
- 12. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков
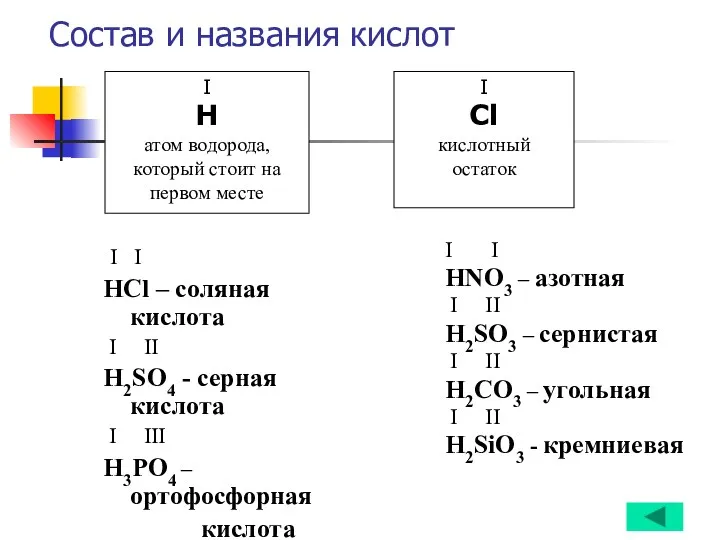
- 13. Состав и названия кислот I I НCl – соляная кислота I II Н2SO4 - серная кислота
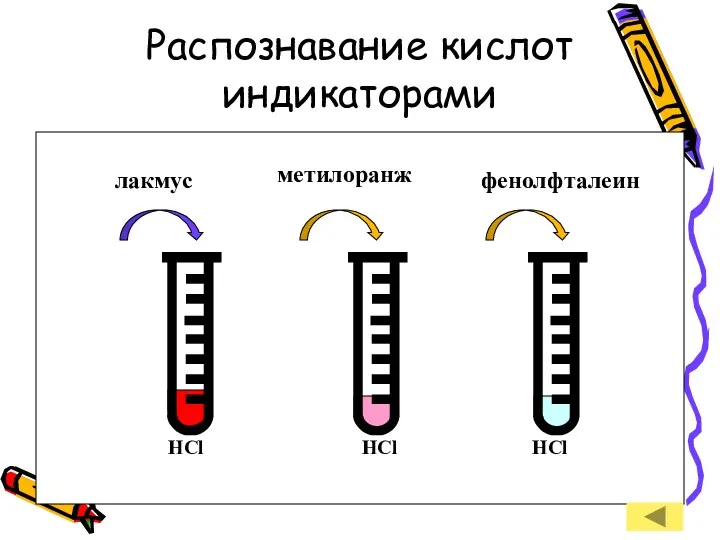
- 14. Распознавание кислот индикаторами лакмус метилоранж фенолфталеин HCl HCl HCl
- 15. Mg + H2SO4 = MgSO4 +H2↑
- 16. Соли – это сложные вещества, состоящие из атомов металла и кислотного остатка
- 17. Даны вещества: СаО, Са(NO3)2 , Ca(OH)2 FeCI2 , HCI, H2O, ZnS, H2SO4 ,CuSO4 Mg3 (PO4)2 ,HgCI2
- 18. Ca, K, Li, Ba, Zn, Mg, Fe, Cu, Pb, Hg. II II II I III II
- 19. 1. Я узнал(а) много нового. 2. Мне это пригодится в жизни. 3. На уроке было над
- 21. Скачать презентацию










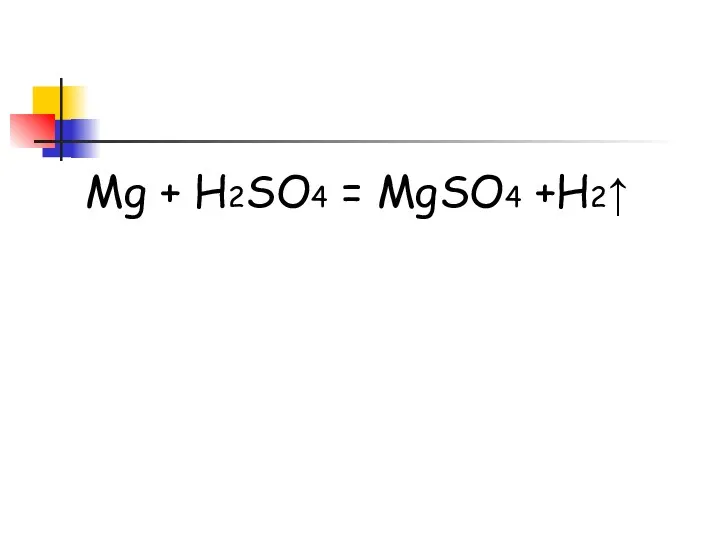




 Презентация к классному часу (2 класс). Тема: Сталинград и КУбань 2 февраля - День разгрома советскими войсками немецко-фашистских войск в Сталинградской битве (1943 год)
Презентация к классному часу (2 класс). Тема: Сталинград и КУбань 2 февраля - День разгрома советскими войсками немецко-фашистских войск в Сталинградской битве (1943 год) ГК СтройГарант
ГК СтройГарант Критерии классификации правовых систем
Критерии классификации правовых систем презентация Молоко и молочные продукты
презентация Молоко и молочные продукты Контроллеры для систем вентиляции и кондиционирования
Контроллеры для систем вентиляции и кондиционирования Прием в первый класс
Прием в первый класс Neural Networks
Neural Networks Диктант Победы
Диктант Победы Первый и второй этапы сестринского процесса. Лекция 8
Первый и второй этапы сестринского процесса. Лекция 8 Создание изделий из текстильных материалов. Швейные ручные работы
Создание изделий из текстильных материалов. Швейные ручные работы Советы по созданию презентации в программе Microsoft Office PowerPoint
Советы по созданию презентации в программе Microsoft Office PowerPoint История развития гостиничной индустрии
История развития гостиничной индустрии Крепкий алкоголь
Крепкий алкоголь ЕВРАЗ: город друзей – город идей! Создание современной спортивно – игровой площадки на территории детского сада
ЕВРАЗ: город друзей – город идей! Создание современной спортивно – игровой площадки на территории детского сада Имя существительное
Имя существительное Виды мультфильмов, техники создания. Урок 1
Виды мультфильмов, техники создания. Урок 1 Комедия А.С. Грибоедова Горе от ума
Комедия А.С. Грибоедова Горе от ума Набір ювелірних каблучок Сонячний вітер
Набір ювелірних каблучок Сонячний вітер Элемент занятия по экономике
Элемент занятия по экономике Виды симметрии
Виды симметрии Изделия из соленого теста Подарок на день рождения
Изделия из соленого теста Подарок на день рождения Организация деятельности психолого-педагогического консилиума образовательной организации
Организация деятельности психолого-педагогического консилиума образовательной организации Организация речевого уголка в ДОУ
Организация речевого уголка в ДОУ Самооценка системы управления организации на базе функциональной модели оценки менеджмента
Самооценка системы управления организации на базе функциональной модели оценки менеджмента Противодействие преступлениям в сфере компьютерной информации в РФ. (Лекция 4)
Противодействие преступлениям в сфере компьютерной информации в РФ. (Лекция 4) Астенопия - синдром усталости глаза
Астенопия - синдром усталости глаза Презентация к уроку в 9 классе Химические свойства непредельных углеводородов
Презентация к уроку в 9 классе Химические свойства непредельных углеводородов Условные предложения в английском языке. Conditionals
Условные предложения в английском языке. Conditionals