Содержание
- 2. Период - горизонтальные ряды элементов, которые начинаются активным металлом и заканчиваются инертным газом. В периоде металлические
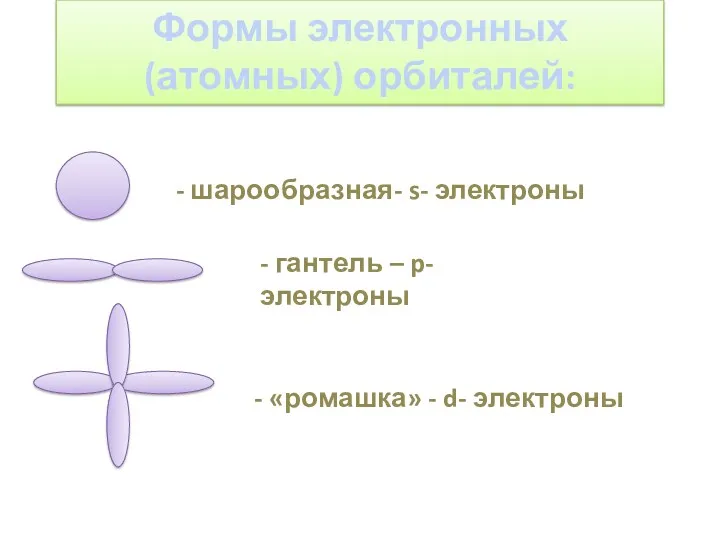
- 3. Формы электронных (атомных) орбиталей: - шарообразная- s- электроны - гантель – p- электроны - «ромашка» -
- 4. Разновидности атомов одного и того же элемента с одинаковым числом протонов, но разным числом нейтронов. A=Z+N
- 5. CL CL 35 17 17 37 N=35-17=18 75% N=37-17=20 25% 35 * 0,75 + 37 *
- 6. Методика написания электронных и графических формул N=2n 2 N – максимальное количество электронов в периоде, n
- 8. Скачать презентацию




 Нерв жүйесі ауруларын диагностикалаудың нейровизуализациялық әдістері. КТ, МРТ кабинеттерінде жұмыс жасау
Нерв жүйесі ауруларын диагностикалаудың нейровизуализациялық әдістері. КТ, МРТ кабинеттерінде жұмыс жасау Английская буржуазная революция
Английская буржуазная революция Александр Невский
Александр Невский Узнай народ
Узнай народ Переменный ток. Генератор переменного тока. Трансформатор. Производство, передача и использование энергии электрического тока
Переменный ток. Генератор переменного тока. Трансформатор. Производство, передача и использование энергии электрического тока Модернизированная переносная станция наземной разведки ПСНР-8М
Модернизированная переносная станция наземной разведки ПСНР-8М Национальная кухня Америки
Национальная кухня Америки Культурно-смысловые контексты для познавательно-исследовательской деятельности
Культурно-смысловые контексты для познавательно-исследовательской деятельности практическая работа 8
практическая работа 8 Ранний железный век лесной полосы Восточной Европы
Ранний железный век лесной полосы Восточной Европы Частотные преобразователи
Частотные преобразователи Решение уравнений
Решение уравнений Ivan Shishkin
Ivan Shishkin Этика аудиторов
Этика аудиторов Принцип работы однофазного счетчика электроэнергии
Принцип работы однофазного счетчика электроэнергии Повторение. Решение примеров и задач.
Повторение. Решение примеров и задач. Атмосфера. 6 класс
Атмосфера. 6 класс Интегрированные уроки математики и информатики в профильном классе Информационно–технологический. .Интегрированный урок математики и информатики в 10 классе по теме Практическое применение показательной функции и способы ее выч
Интегрированные уроки математики и информатики в профильном классе Информационно–технологический. .Интегрированный урок математики и информатики в 10 классе по теме Практическое применение показательной функции и способы ее выч Девиз кружка: Твори, выдумывай, пробуй
Девиз кружка: Твори, выдумывай, пробуй Масленица
Масленица Пакт Молотова - Риббентропа
Пакт Молотова - Риббентропа Ауыл шаруашылығының жалпы сипаты
Ауыл шаруашылығының жалпы сипаты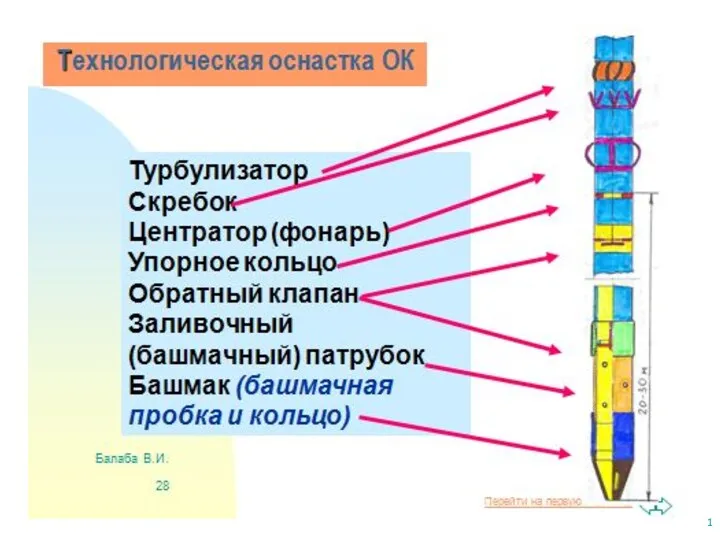 Оснастка обсадных колонн
Оснастка обсадных колонн 1С:Бухгалтерия государственного учреждения 8, редакция 2.0
1С:Бухгалтерия государственного учреждения 8, редакция 2.0 Знаменитые люди Кировской области, России
Знаменитые люди Кировской области, России Шаблон презентации С днем Защитника Отечества - парадный
Шаблон презентации С днем Защитника Отечества - парадный Заболевания житовидной железы. Йоддефицитные заболевания. Эндемический зоб
Заболевания житовидной железы. Йоддефицитные заболевания. Эндемический зоб Модель организации методической работы в муниципальном общеобразовательном учреждении Барашевская средняя общеобразовательная школа
Модель организации методической работы в муниципальном общеобразовательном учреждении Барашевская средняя общеобразовательная школа