Содержание
- 2. ЦЕЛИ УРОКА: Повторить особенности строения атомов неметаллов, положение неметаллов в Периодической таблице. Познакомить с физическими свойствами
- 3. Мы с вами побываем в одной удивительной стране. Коренные жители этой страны назывались… Впрочем, догадайтесь сами
- 4. Физические свойства: Твердые: сера (S), фосфор (красный, белый), йод, углерод (алмаз, графит). 2. Газообразные: кислород, озон,
- 5. Для неметаллов характерна разнообразная цветовая гамма: белый ,черный ,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод,
- 6. Аллотропия – это явление обусловлено двумя причинами: Различным числом атомов в молекуле (О2,О3); 2.Образование различных кристаличесих
- 8. Кислород О2 и озон О3 Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде,
- 9. Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 10. Алмаз Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при
- 11. Куллинан (алмаз)- 621,35 грамма, размеры: 100х65х50 мм Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
- 12. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 13. Графит
- 14. Фосфор Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен
- 15. Биологическая роль соединений фосфора Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит
- 16. Белый, красный, чёрный и металлический фосфор
- 17. Белый фосфор Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему
- 18. Красный фосфор Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. Имеет оттенки
- 19. Чёрный фосфор Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма
- 20. Металлический фосфор При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую
- 21. ФИЗКУЛЬТМИНУТКА Потрудились – отдохните, Влево – вправо посмотрите, Глубоко разок вздохните, Сделав это, улыбнитесь, За работу
- 22. Просмотр видео урока
- 24. Скачать презентацию




















 Классификация налогов
Классификация налогов Тема 3. Фундаментальный анализ рынков ценных бумаг
Тема 3. Фундаментальный анализ рынков ценных бумаг Проектная деятельность в дошкольных образовательных учреждениях
Проектная деятельность в дошкольных образовательных учреждениях Расселение в России старообрядцев после церковного раскола
Расселение в России старообрядцев после церковного раскола Презентация:Развитие оптико - пространственных представлений у детей дошкольного возраста
Презентация:Развитие оптико - пространственных представлений у детей дошкольного возраста Солнце, растения, человек
Солнце, растения, человек Инфузионная терапия у детей
Инфузионная терапия у детей 20230829_kak_otkryt_zakrytye_dveri
20230829_kak_otkryt_zakrytye_dveri Конкурсные работы по методике В.Ф.Шаталова
Конкурсные работы по методике В.Ф.Шаталова Керамика и стекло
Керамика и стекло День российской науки
День российской науки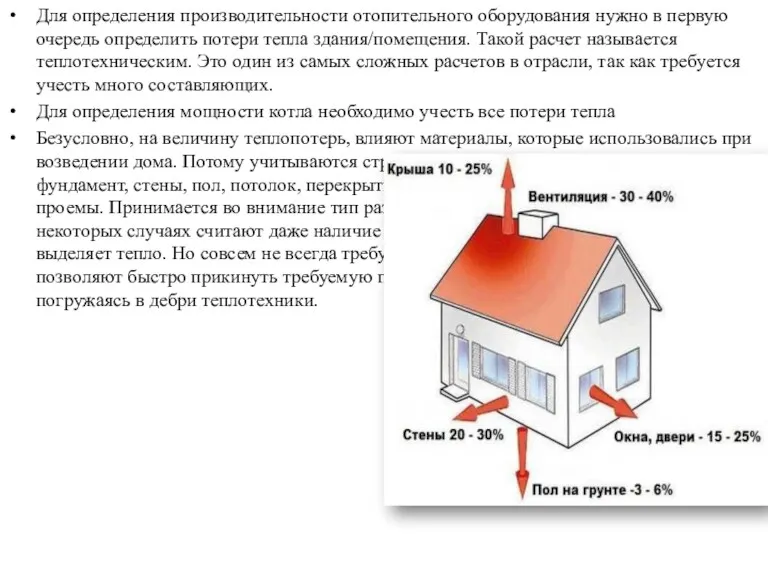 Расчет мощности котла отопления по площади
Расчет мощности котла отопления по площади Трудности обучения письму и чтению в начальных классах
Трудности обучения письму и чтению в начальных классах Презентация Мини музей народной куклы
Презентация Мини музей народной куклы Киноафоризмы
Киноафоризмы Презентация к уроку технологии Пластилиновый аквариум в банке
Презентация к уроку технологии Пластилиновый аквариум в банке Музеи Москвы. Палеонтологический музей.
Музеи Москвы. Палеонтологический музей. Презентация бизнес-плана по предмету: Маркетинг в организациях общественного питания
Презентация бизнес-плана по предмету: Маркетинг в организациях общественного питания Мастер-класс Грибное лукошко
Мастер-класс Грибное лукошко Принятие управленческих решений
Принятие управленческих решений Пособия и компенсации, как виды социального обеспечения
Пособия и компенсации, как виды социального обеспечения Отряд хищные. Семейство медвежьи
Отряд хищные. Семейство медвежьи Интерактивный тренажёр. Русский язык 2-4 класс
Интерактивный тренажёр. Русский язык 2-4 класс Презентация Старый новый год
Презентация Старый новый год Создание прикладной базы данных с помощью приложения MS Access для хранения результатов тестирования по методу Стерляу
Создание прикладной базы данных с помощью приложения MS Access для хранения результатов тестирования по методу Стерляу Математическая игра Мы живем в Наукограде. Город Жуковский
Математическая игра Мы живем в Наукограде. Город Жуковский Презентация Удивительные животные
Презентация Удивительные животные Биостимуляторы. Гиполипидемические средства
Биостимуляторы. Гиполипидемические средства