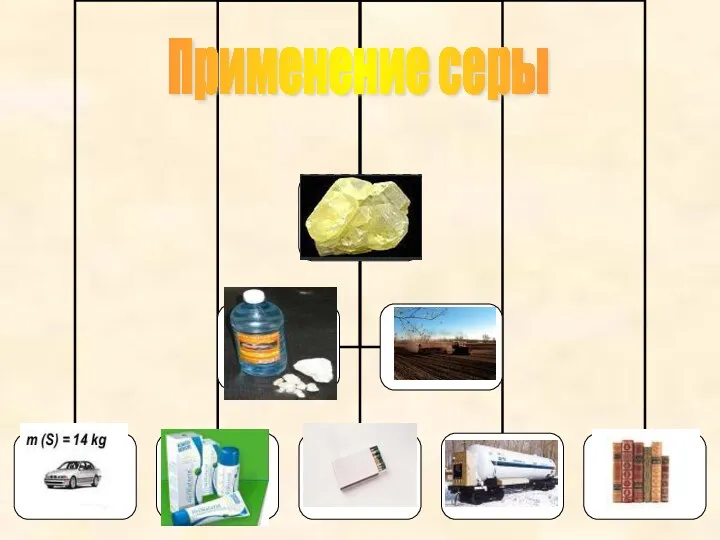
Физические свойства серы
Сера представляет собой лимонно-желтое кристаллическое вещест-
во с
плотностью около 2 г /см3, плавящееся при температуре 1190С и
кипящее при 4440С. Она не проводит тепло и электрический ток. В во-
де сера не растворяется и не смачивается водой. Лучшим её растворителем является сероуглерод CS2.
У жёлтой серы есть
корона,
Но нет ни подданных,
ни трона,
Корону сера надевает,
Когда устойчивой
бывает.
Тепло ведёт к кристаллам
длинным
Бесцветной серы
моноклинной.
Для твердой элементарной серы типичны две аллотропные моди-
фикации. Ниже 95,60С устойчива обычная жёлтая сера с плотностью
2,07г/ см3 и температурой плавления 112,80С. Различие обеих моди-
фикаций обусловлено их разной кристаллической структурой.
Ромбическая и моноклинная сера всегда состоит из восьмизвен-
ных кольцевых молекул S8. Ромбическая сера – желтого цвета, моно-
клинная – бледно-желтого. В неё при комнат-
ной температуре превращаются все другие
формы.
Пластическая сера – коричневая резинопо-
добная масса. Она состоит из нерегулярно
расположенных зигзагообразных цепочек S8.
В парах серы обнаружены молекулы S8, S6,
S4, S2.







 Проект Формирование социальных установок на здоровый образ жизни у подростков
Проект Формирование социальных установок на здоровый образ жизни у подростков Культура постмодернизма
Культура постмодернизма Источники пластовой энергии. Вскрытие пластов. Вызов притока нефти и газа в скважины
Источники пластовой энергии. Вскрытие пластов. Вызов притока нефти и газа в скважины Сертификация. Оценка соответствия
Сертификация. Оценка соответствия Современные технологии музыкального воспитания детей дошкольного возраста
Современные технологии музыкального воспитания детей дошкольного возраста Базовые характеристики микроконтроллера К1921ВК01Т. (Лекция 3)
Базовые характеристики микроконтроллера К1921ВК01Т. (Лекция 3) Анализ своевременного погашения и обеспеченности банковских кредитов
Анализ своевременного погашения и обеспеченности банковских кредитов Презентация Интеграция и реализация образовательных областей ФГОС
Презентация Интеграция и реализация образовательных областей ФГОС Инфаркт миокарда
Инфаркт миокарда Родительское собрание Ответственность
Родительское собрание Ответственность Предметно - развивающая среда ориентированная на ребенка.
Предметно - развивающая среда ориентированная на ребенка. Единая методика социально-психологического тестирования. Вопросы и ответы
Единая методика социально-психологического тестирования. Вопросы и ответы Презентация к празднику детской книги.Знакомство с жизнью и творчеством Н Носова
Презентация к празднику детской книги.Знакомство с жизнью и творчеством Н Носова Проект Урокии мудрости в библиотеке, часть 1
Проект Урокии мудрости в библиотеке, часть 1 Конкурсная работа Первый раз в первый класс!
Конкурсная работа Первый раз в первый класс! Теплопроводы систем отопления. Классификация и материал теплопроводов
Теплопроводы систем отопления. Классификация и материал теплопроводов Экономика и ее роль в обществе. Экономика: научное представление о хозяйственной деятельности
Экономика и ее роль в обществе. Экономика: научное представление о хозяйственной деятельности Great Britain
Great Britain Презентация. по лит. чтению.Федина задача
Презентация. по лит. чтению.Федина задача Анализ принципов формирования оптических модулированных сигналов. . Лекция 8
Анализ принципов формирования оптических модулированных сигналов. . Лекция 8 20231001_ege_mnogogranniki
20231001_ege_mnogogranniki Предмет, концепции и методологическая основа психологии художественного творчества
Предмет, концепции и методологическая основа психологии художественного творчества Политическая элита
Политическая элита Источники теплоты
Источники теплоты Антропогенные трагедии века-Чернобыль
Антропогенные трагедии века-Чернобыль Сварка трубных конструкций
Сварка трубных конструкций Функции управления. Контроль.
Функции управления. Контроль. Реклама и игры
Реклама и игры