Содержание
- 2. Положение в Периодической системе: Сера: Порядковый номер № 16 Период : 3 период Группа: VI группа,
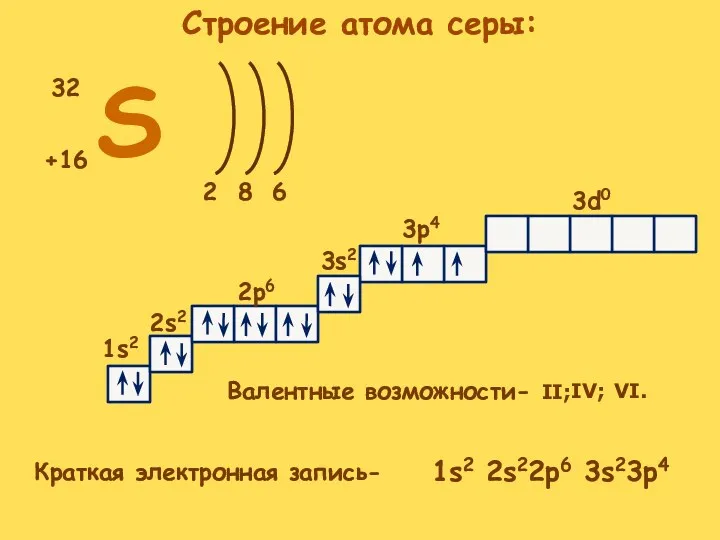
- 3. S +16 32 2 6 8 1s2 2s2 2p6 3s2 3p4 3d0 Краткая электронная запись- Валентные
- 4. Нахождение серы в природе. Сера самородная (S) Цинковая обманка (сфалерит ZnS) Киноварь (HgS) Свинцовый блеск (галенит
- 5. Сера самородная
- 6. Сера самородная
- 7. Сера самородная
- 8. Сера самородная
- 9. Сера самородная
- 10. Историческая справка. Cера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже
- 11. Историческая справка Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для
- 12. Историческая справка В 11 в. алхимики полагали, что металлы, в том числе золото и серебро, состоят
- 13. Историческая справка. Практическое значение серы резко возросло после того, как изобрели черный порох (в состав которого
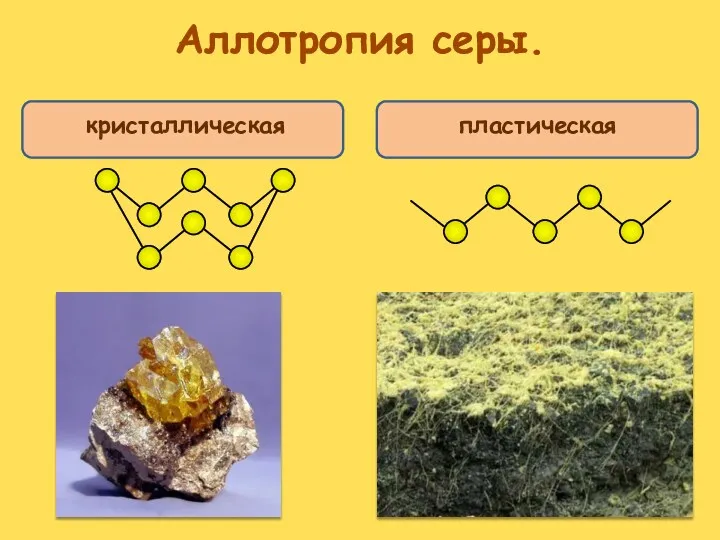
- 14. Аллотропия серы. Аллотропия – явление, когда один химический элемент образует несколько простых веществ. Сами простые вещества,
- 15. Аллотропия серы. кристаллическая пластическая
- 16. Физические свойства. — твердое агрегатное состояние — желтого цвета — не растворима в воде — не
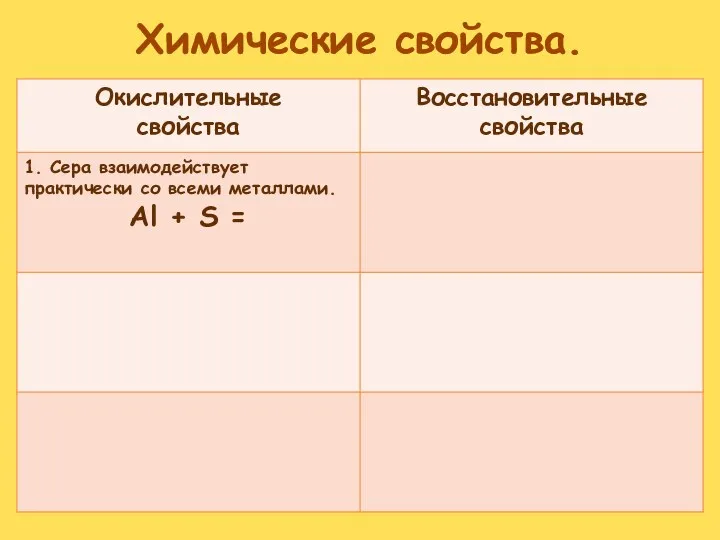
- 17. Химические свойства Окислительные свойства серы S0 + 2ē S-2
- 18. Химические свойства Восстановительные свойства S - 2ē S+2; S - 4ē S+4; S -
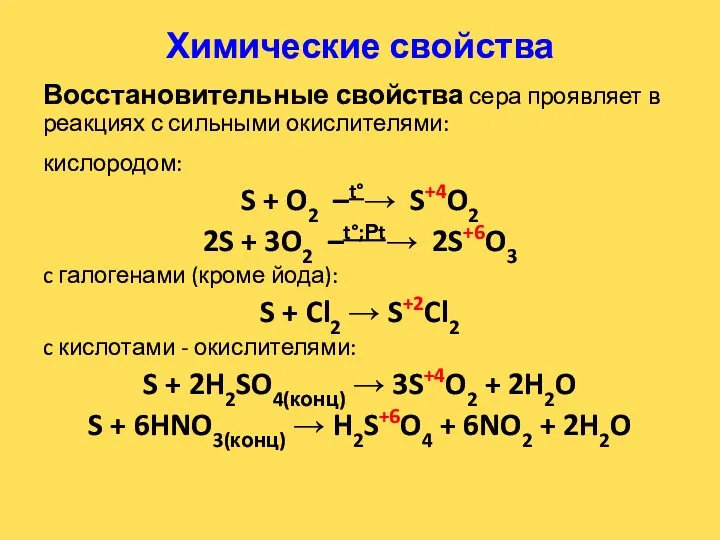
- 19. Химические свойства Восстановительные свойства сера проявляет в реакциях с сильными окислителями: кислородом: S + O2 –t
- 20. Химические свойства.
- 21. Химические свойства.
- 22. Химические свойства.
- 23. Химические свойства.
- 24. Химические свойства.
- 25. Химические свойства.
- 26. Химические свойства.
- 27. Химические свойства.
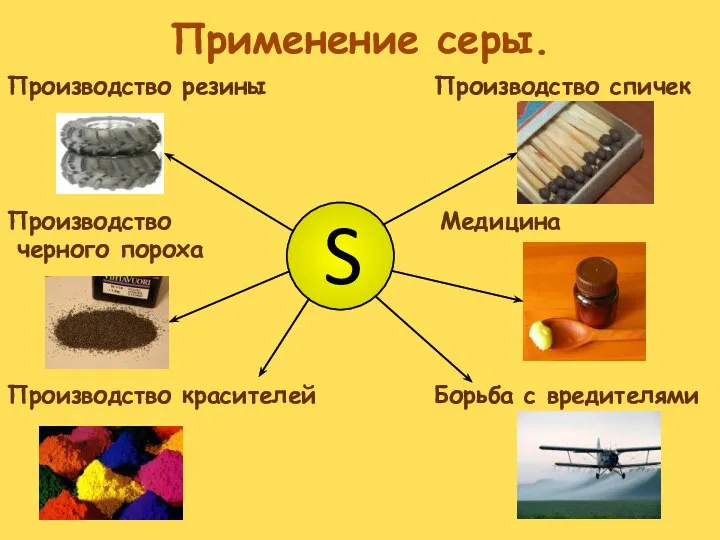
- 28. Применение серы. Производство спичек Медицина Борьба с вредителями
- 29. Напишите уравнения реакций S → SO2 → SO3 → H2SO4 → CaSO4
- 31. Скачать презентацию






















 Алхимия. Мифы и реальность
Алхимия. Мифы и реальность Русский народный праздничный костюм
Русский народный праздничный костюм Экономическое образование в системе общего образования. (Лекция 4)
Экономическое образование в системе общего образования. (Лекция 4) Аксиально-поршневые гидромашины
Аксиально-поршневые гидромашины Теоретические основы БЖД
Теоретические основы БЖД День Матери
День Матери Новітні методи контролю якості й безпечності м’яса і м’ясних товарів
Новітні методи контролю якості й безпечності м’яса і м’ясних товарів Традиции нашего класса
Традиции нашего класса 01
01 Организм и его свойства
Организм и его свойства How to save electricity
How to save electricity Надя Рушева- девочка-гений
Надя Рушева- девочка-гений Рак тела матки
Рак тела матки Картотека русских-народных игр
Картотека русских-народных игр Миокардиодистрофия. Этиология и патогенез миокардиодистрофии
Миокардиодистрофия. Этиология и патогенез миокардиодистрофии Основы шрифта и технологии графики
Основы шрифта и технологии графики Підприємства у твоєму населеному пункті
Підприємства у твоєму населеному пункті Проектная деятельность
Проектная деятельность Декоративная композиция Фауна
Декоративная композиция Фауна Внутрипартийная борьба в 20-е годы ХХ века в России
Внутрипартийная борьба в 20-е годы ХХ века в России Театры города Казани
Театры города Казани Деловая игра как способ совершенствования личности ребенка
Деловая игра как способ совершенствования личности ребенка Проект Как сделать творог в домашних условиях
Проект Как сделать творог в домашних условиях Энергетический паспорт здания
Энергетический паспорт здания КВН гидросфера
КВН гидросфера КРД engine indicating расходомеры топлива. Engine indicating. Расходомеры топлива
КРД engine indicating расходомеры топлива. Engine indicating. Расходомеры топлива Перспектива (Основные понятия)
Перспектива (Основные понятия) Как добиться прозрачности и контролируемости бизнеса
Как добиться прозрачности и контролируемости бизнеса