Содержание
- 2. Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.
- 3. Фосфор занимает 12-е место по распространенности элементов в природе. Он входит в состав многих горных пород
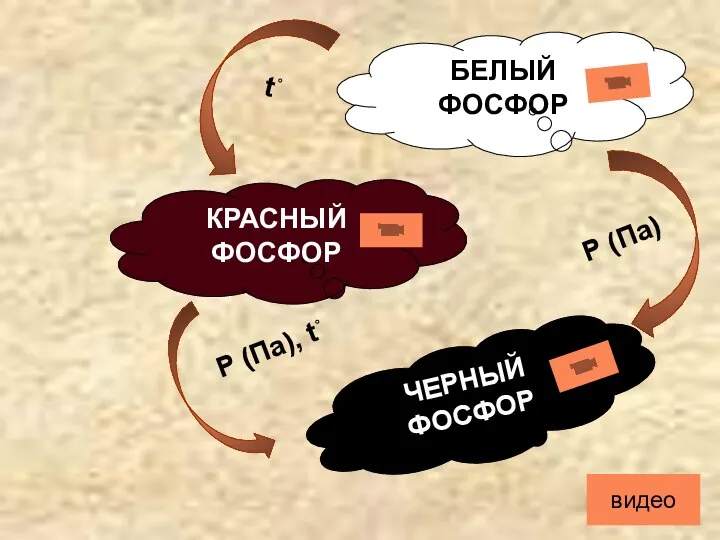
- 4. Аллотропия БЕЛЫЙ ФОСФОР КРАСНЫЙ ФОСФОР ЧЕРНЫЙ ФОСФОР Р (Па), t˚ Р (Па) t˚ видео
- 5. Химические свойства
- 6. Взаимодействие с простыми веществами - неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с
- 7. Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P = Mg3P2 Фосфиды
- 8. Взаимодействие с конц. азотной кислотой: 3Р + 5HNO3 + 2H2O = 3H3PO4 + 5NO 0 -3
- 9. Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов и фторапатитов. Метод получения
- 11. Скачать презентацию







 Железобетонные конструкции. Введение
Железобетонные конструкции. Введение Нетрадиционные формы проведения родительских собраний
Нетрадиционные формы проведения родительских собраний Изучение таблицы умножения
Изучение таблицы умножения презентация к пректу Кто в Волгограде не бывал, тот красоты не видал
презентация к пректу Кто в Волгограде не бывал, тот красоты не видал Сущность поликультурного образования в Европе
Сущность поликультурного образования в Европе Толерантность
Толерантность Живые системы и экосистемы. (9 класс)
Живые системы и экосистемы. (9 класс) Эволюция фонетического строя английского языка
Эволюция фонетического строя английского языка Физики - герои труда
Физики - герои труда Анализ выполнения производственной программы по растениеводству
Анализ выполнения производственной программы по растениеводству Генетика. Взаимодействие генов
Генетика. Взаимодействие генов Работа с инструментом Перо
Работа с инструментом Перо сложение отрицательных чисел
сложение отрицательных чисел Система управления морально-психологическим обеспечением личного состава подразделения. (Тема 18.2)
Система управления морально-психологическим обеспечением личного состава подразделения. (Тема 18.2) Формы организации обучения
Формы организации обучения Психологичексие особенности детей с нарушением речи
Психологичексие особенности детей с нарушением речи Философия любви
Философия любви Формування транспортного пакету з використанням контейнерів
Формування транспортного пакету з використанням контейнерів Насекомые. Знакомство
Насекомые. Знакомство Технология очистки природных и сточных вод. Очистные сооружения водопровода г. Златоуста
Технология очистки природных и сточных вод. Очистные сооружения водопровода г. Златоуста Дефект смягчения. Специфика работы.
Дефект смягчения. Специфика работы. Элементы экрана. Рабочий стол Windows XP (desktop)
Элементы экрана. Рабочий стол Windows XP (desktop) Памятка пользователя сервиса “Электронная регистрация”
Памятка пользователя сервиса “Электронная регистрация” Speaking 4 JOBS
Speaking 4 JOBS Геометрические тела в пространстве. Смотр знаний
Геометрические тела в пространстве. Смотр знаний Конструкции фильтров
Конструкции фильтров Санкт-Петербург-самый северный из крупнейших городов
Санкт-Петербург-самый северный из крупнейших городов Новая упаковка СДЭК
Новая упаковка СДЭК