Содержание
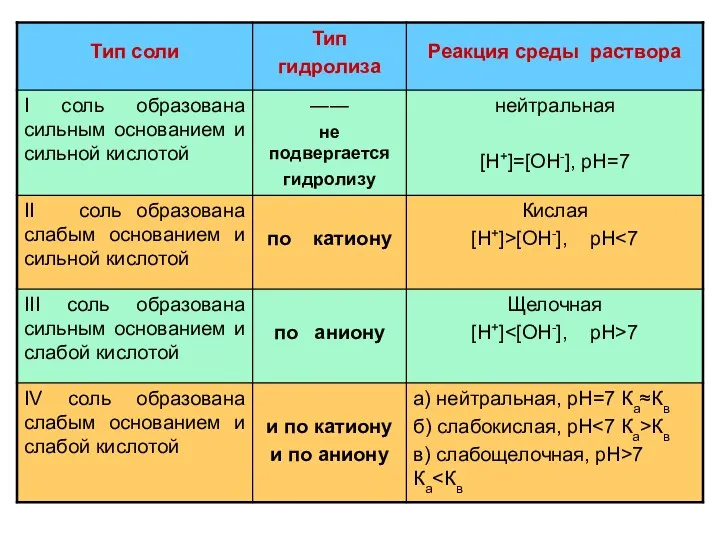
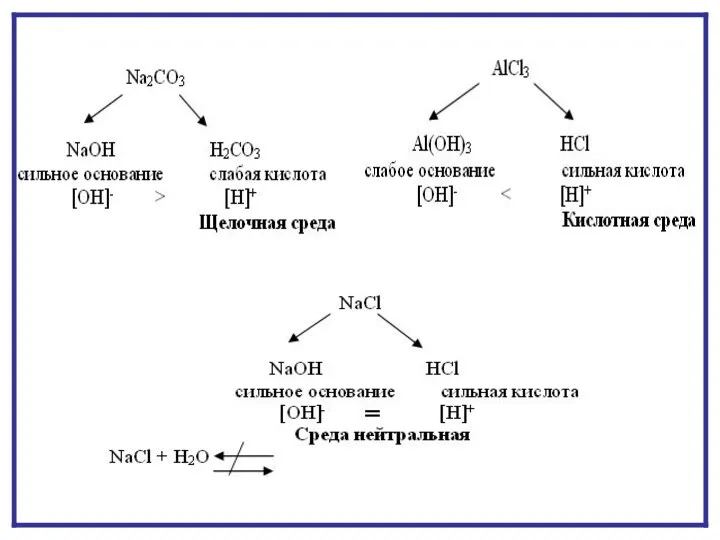
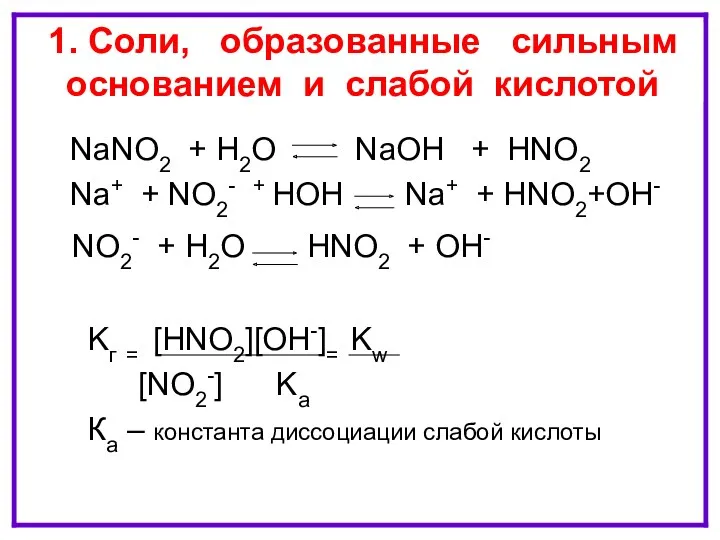
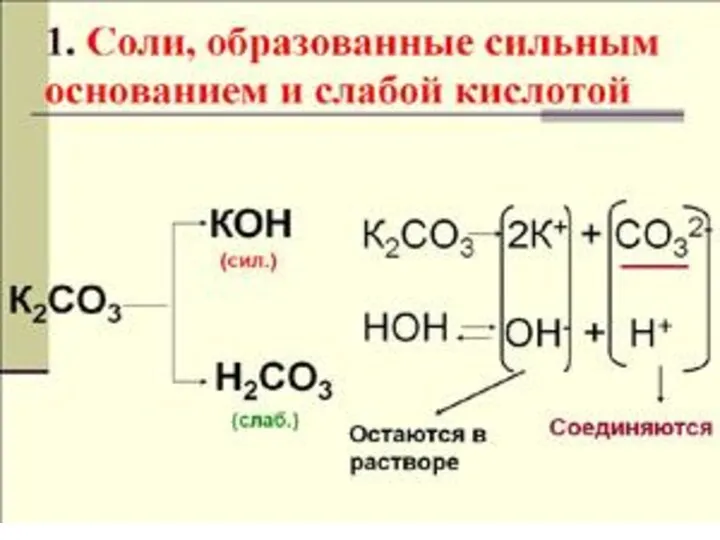
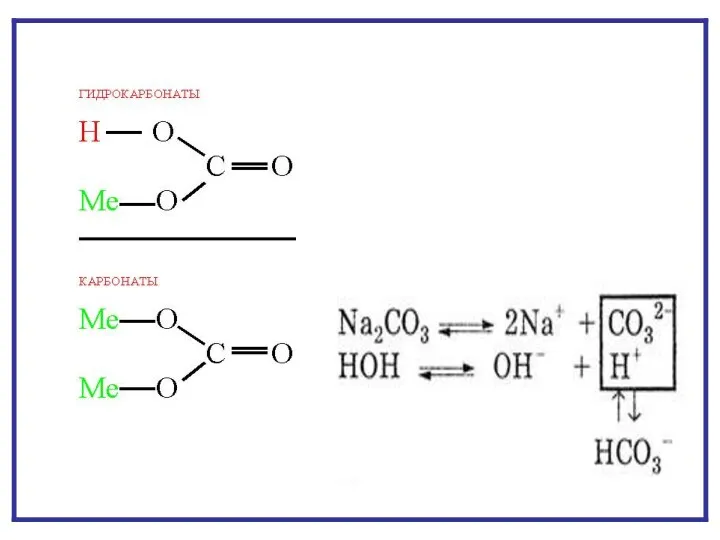
- 7. ГИДРОЛИЗ ПО АНИОНУ NaNO2 + H2O NaOH + HNO2 Na+ + NO2- + HOH Na+ +
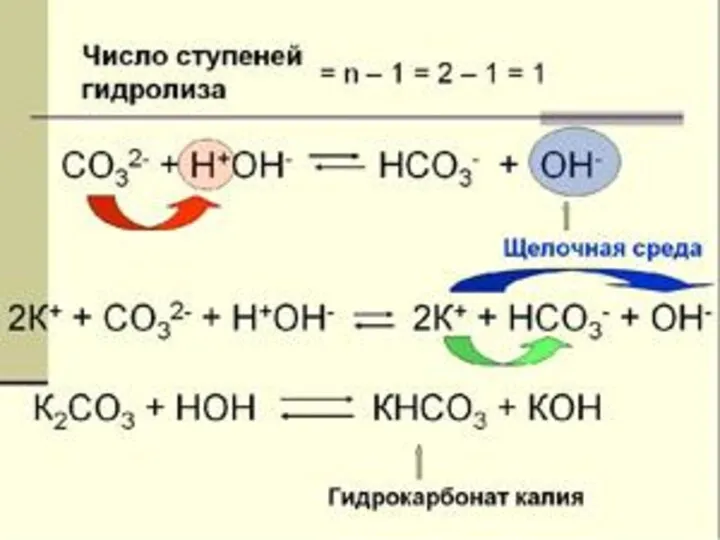
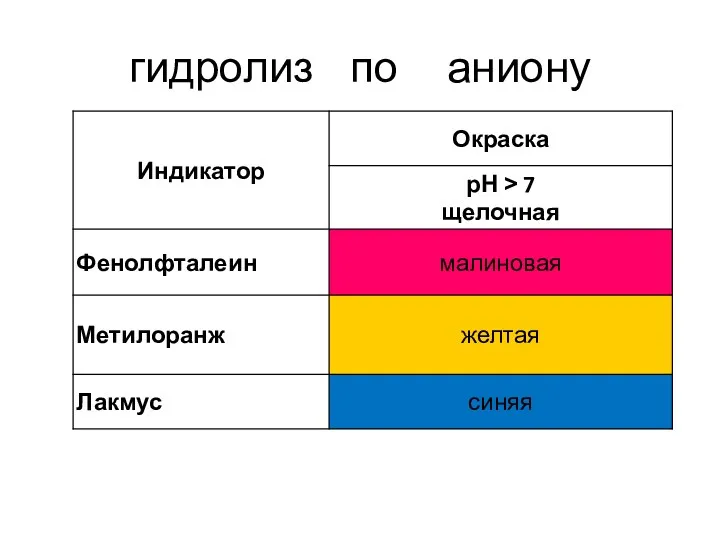
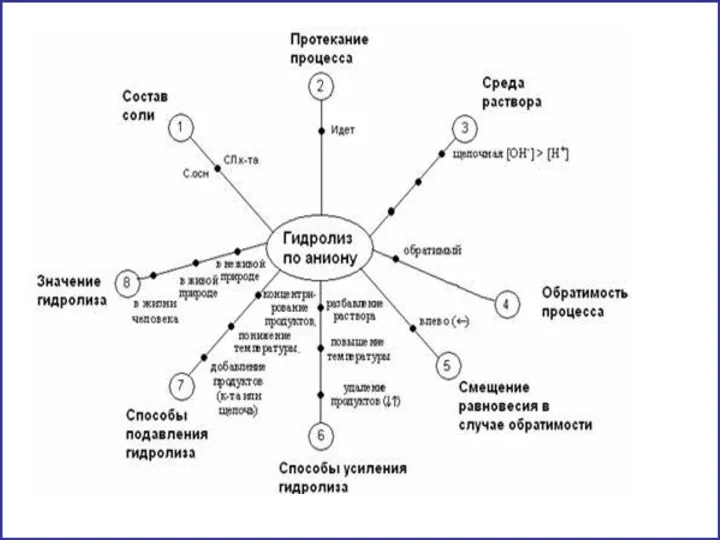
- 11. гидролиз по аниону
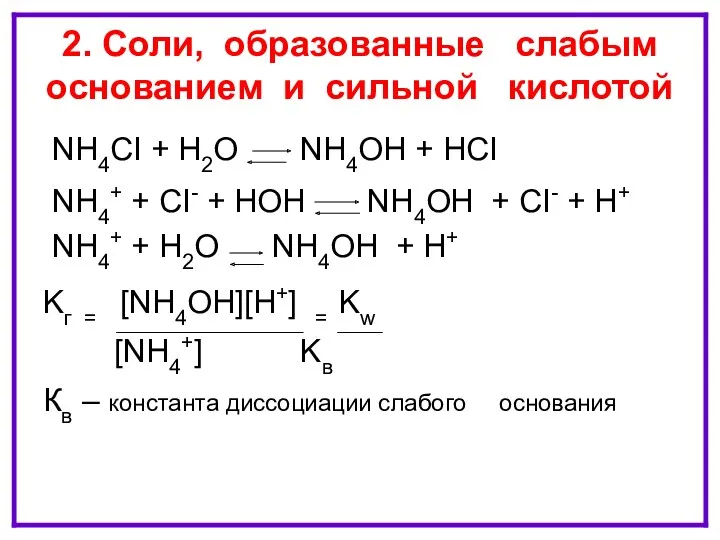
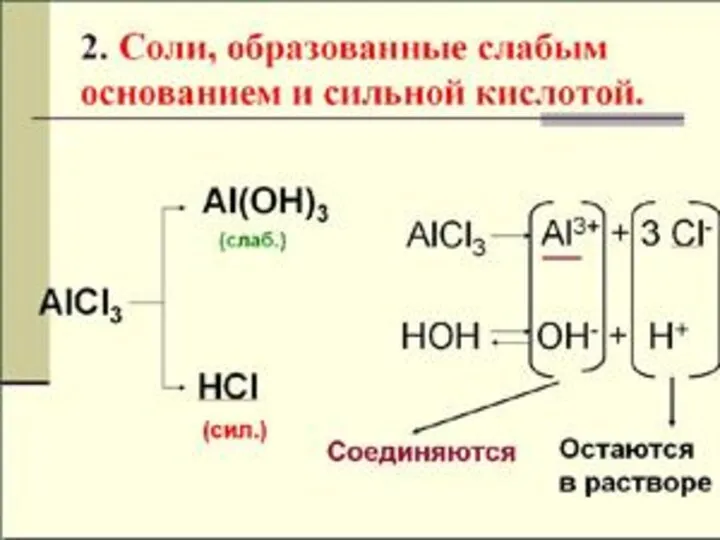
- 12. ГИДРОЛИЗ ПО КАТИОНУ NH4CI + H2O NH4OH + HCI NH4+ + CI- + HOH NH4OH +
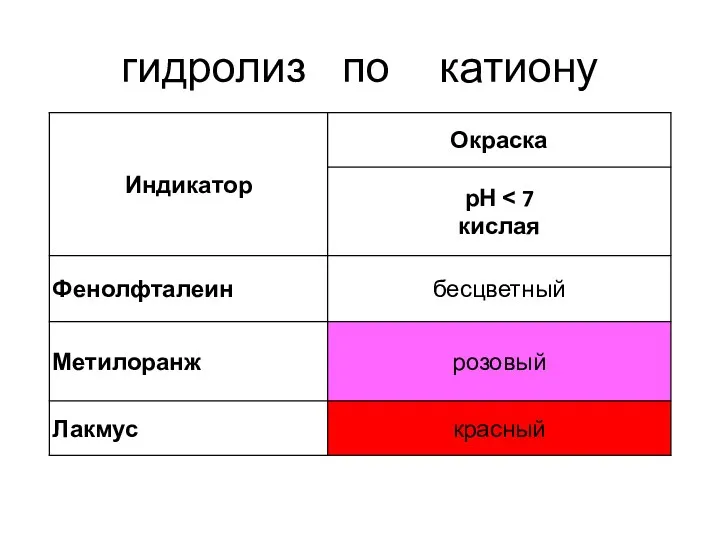
- 17. гидролиз по катиону
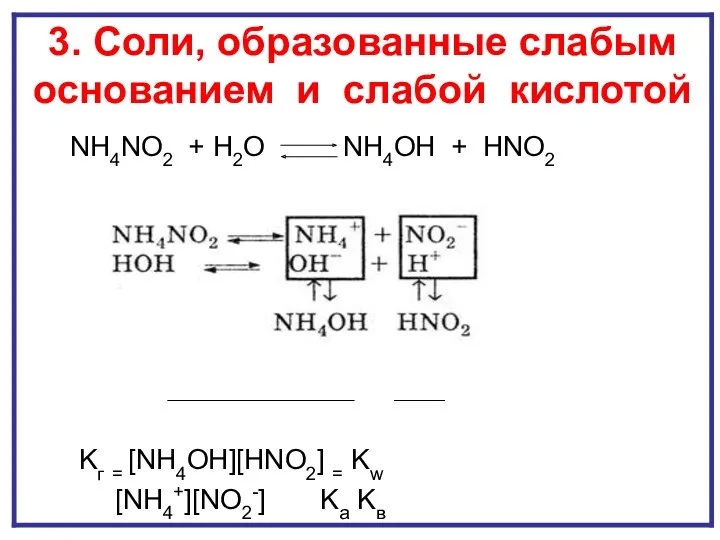
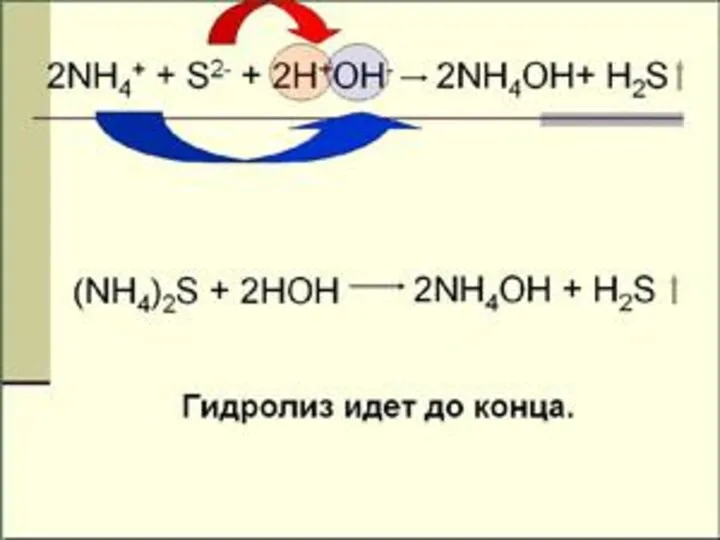
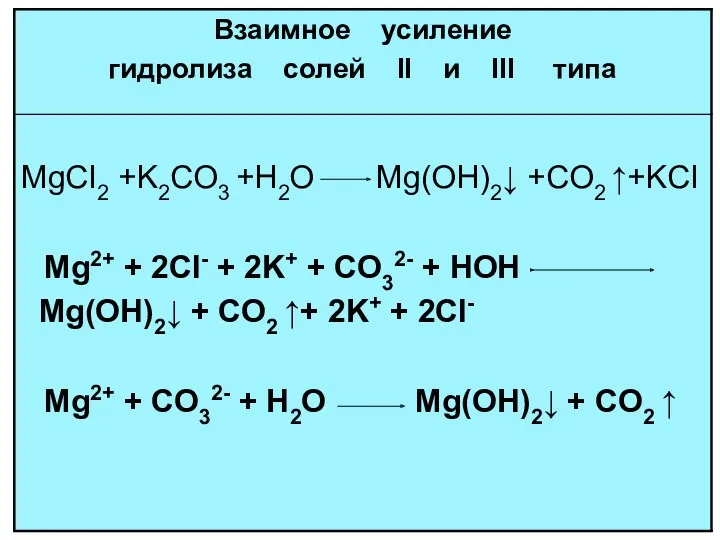
- 18. ГИДРОЛИЗ И ПО КАТИОНУ И ПО АНИОНУ NH4NO2 + H2O NH4OH + HNO2 Kг = [NH4OH][HNO2]
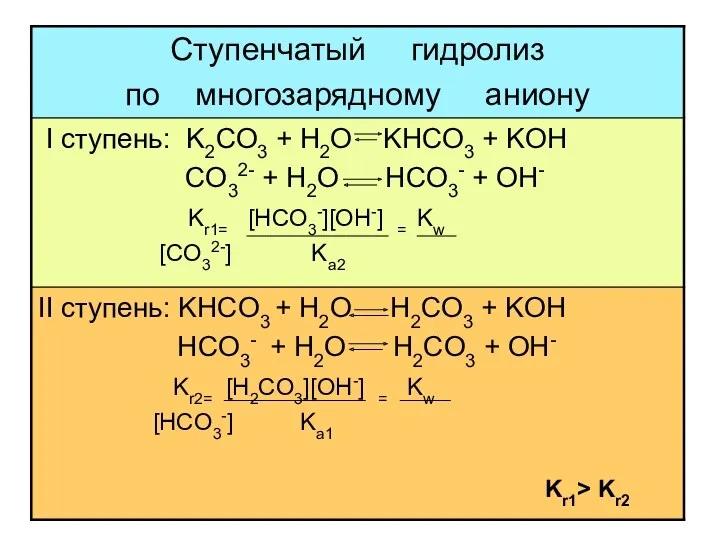
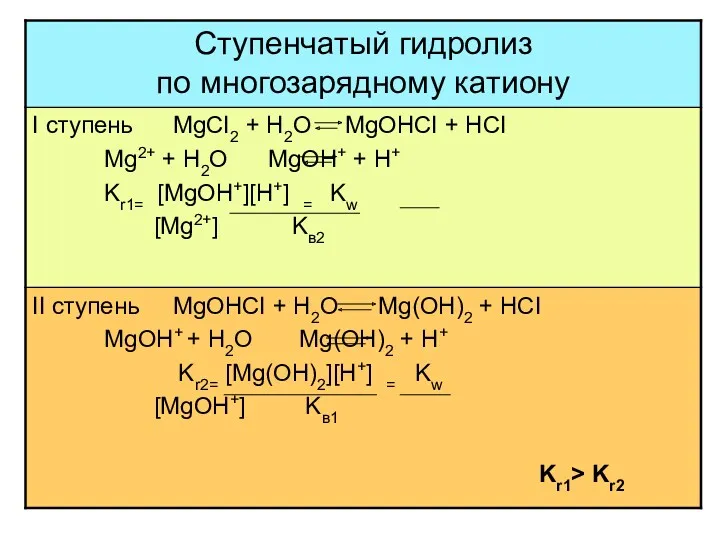
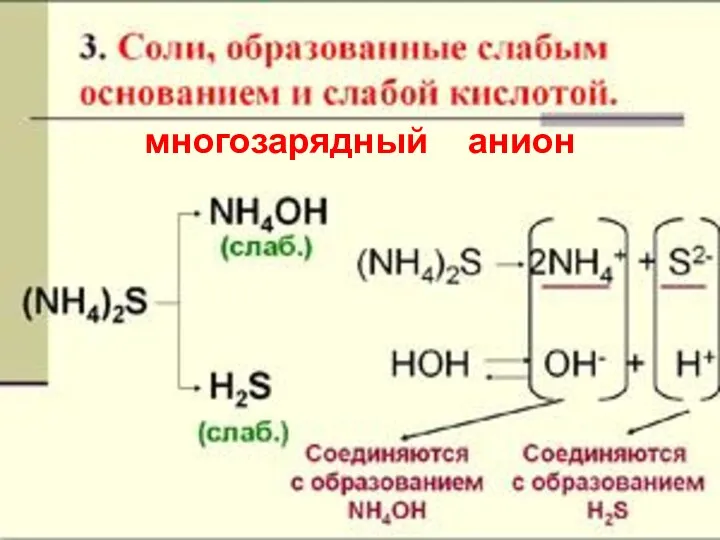
- 19. многозарядный анион
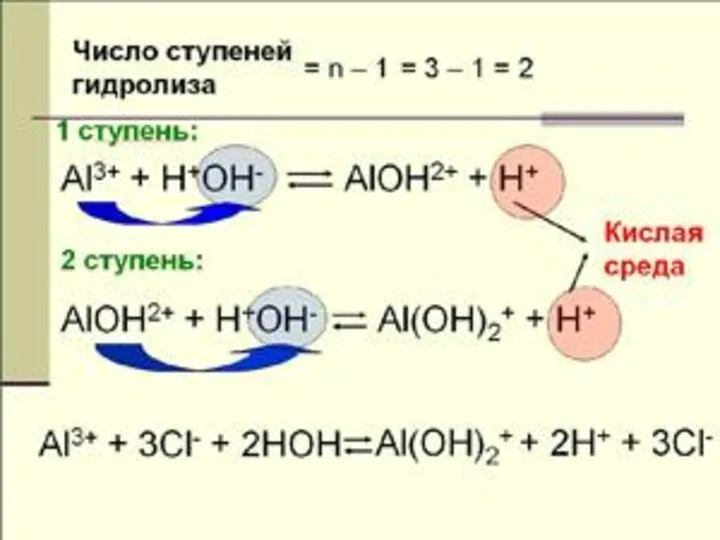
- 21. гидролиз по аниону и по катиону
- 22. Гидролиз некоторых солей также идет до конца, например, Al2S3 + 6H2O → 2 Al(OH)3 ↓ +
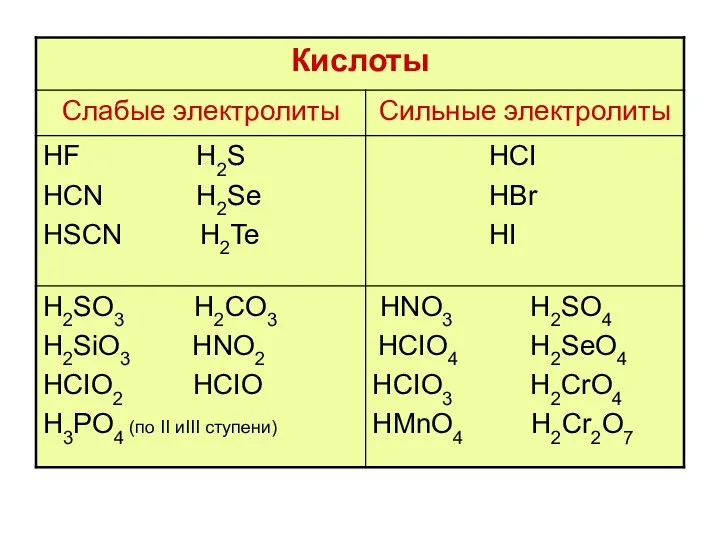
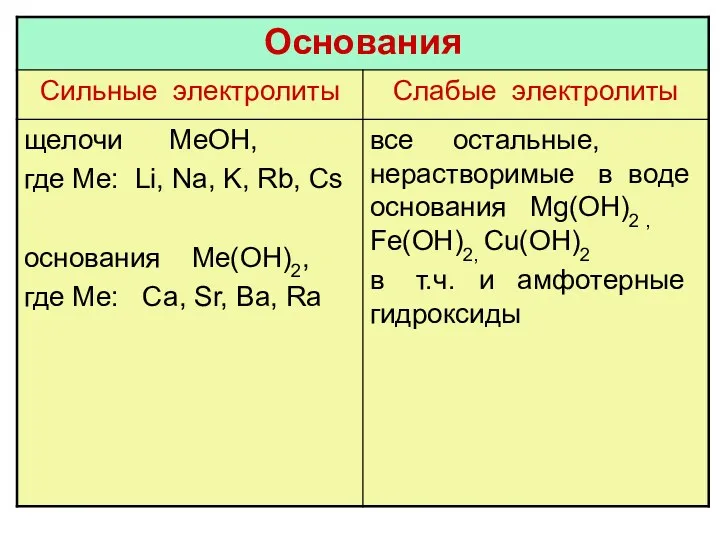
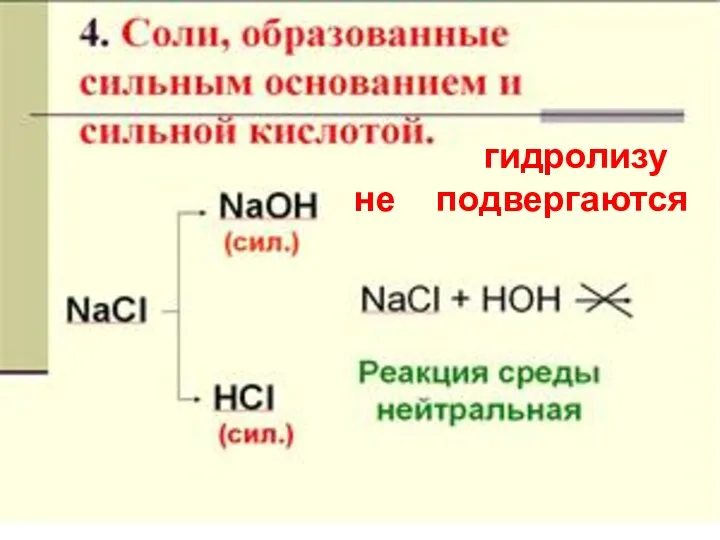
- 23. гидролизу не подвергаются
- 29. Скачать презентацию




 Как вести себя рядом с энергообъектами
Как вести себя рядом с энергообъектами Жизненный и творческий путь Афанасия Афанасьевича Фета. (1820г.-1892г.)
Жизненный и творческий путь Афанасия Афанасьевича Фета. (1820г.-1892г.) Тези до законопроектів щодо запровадження накопичувальної системи пенсій
Тези до законопроектів щодо запровадження накопичувальної системи пенсій Универсальные семейные ценности
Универсальные семейные ценности Работа с учетными записями пользователей в Windows. 10 подробное руководство
Работа с учетными записями пользователей в Windows. 10 подробное руководство Светлая Пасха. История и традиции
Светлая Пасха. История и традиции Занятие 2 Тема 2 Управление ТС в штатных ситуациях
Занятие 2 Тема 2 Управление ТС в штатных ситуациях Страхование спортсменов
Страхование спортсменов Сказочный городок
Сказочный городок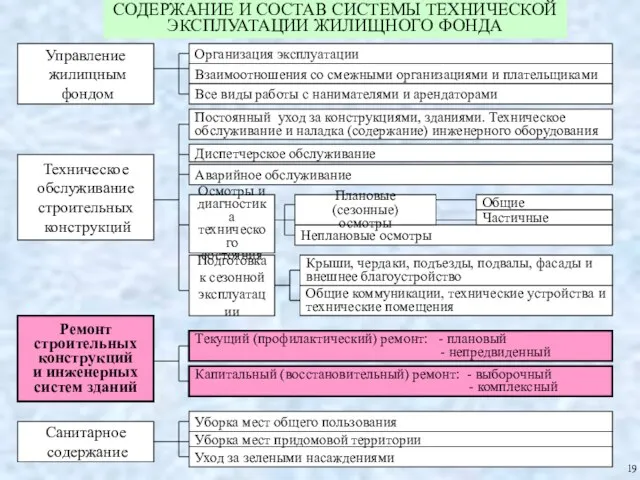 Основные положения по организации и производству ремонтно-строительных работ
Основные положения по организации и производству ремонтно-строительных работ Электронное строение атома. 11 класс.
Электронное строение атома. 11 класс. Этикет. История этикета
Этикет. История этикета Техническая эксплуатация сооружений и устройств путевого хозяйства
Техническая эксплуатация сооружений и устройств путевого хозяйства Сказочный город
Сказочный город Коммерческое предложение. Онлайн-касса Эвотор
Коммерческое предложение. Онлайн-касса Эвотор Неметаллы
Неметаллы Чрезвычайные ситуации химического характера
Чрезвычайные ситуации химического характера Распознавание пластмасс и волокон. Лабораторная работа
Распознавание пластмасс и волокон. Лабораторная работа История создания термометра
История создания термометра Автоматизация и ее применение
Автоматизация и ее применение Художники Марий Эл
Художники Марий Эл Презентация География в танце
Презентация География в танце История и методы изучения клетки. Клеточная теория
История и методы изучения клетки. Клеточная теория Даниил Гранин
Даниил Гранин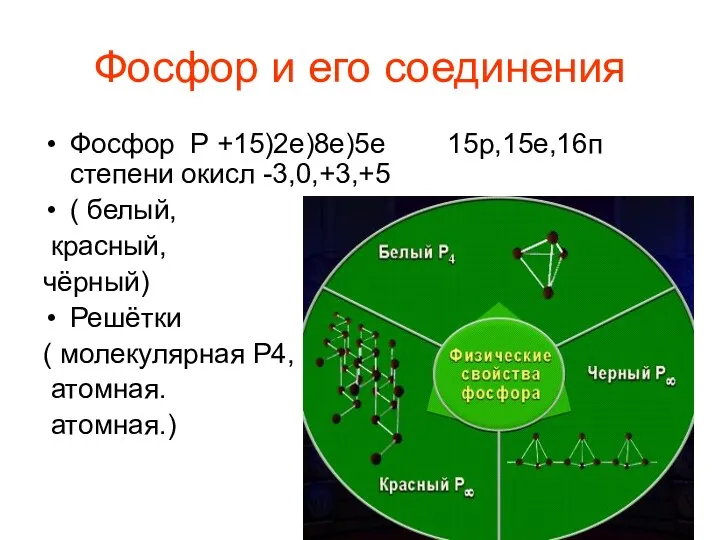 презентация Фосфор, соединения фосфора
презентация Фосфор, соединения фосфора Социальная политика государства и управление социальным развитием организации (Россия и Сингапур)
Социальная политика государства и управление социальным развитием организации (Россия и Сингапур) Игил - Исламское государство
Игил - Исламское государство Эрзянский народный зимний календарь
Эрзянский народный зимний календарь