Содержание
- 2. Цель урока: Изучение закона сохранения массы вещества Задачи: Обучение учащихся составлению уравнений химических реакций Усвоение учащимися
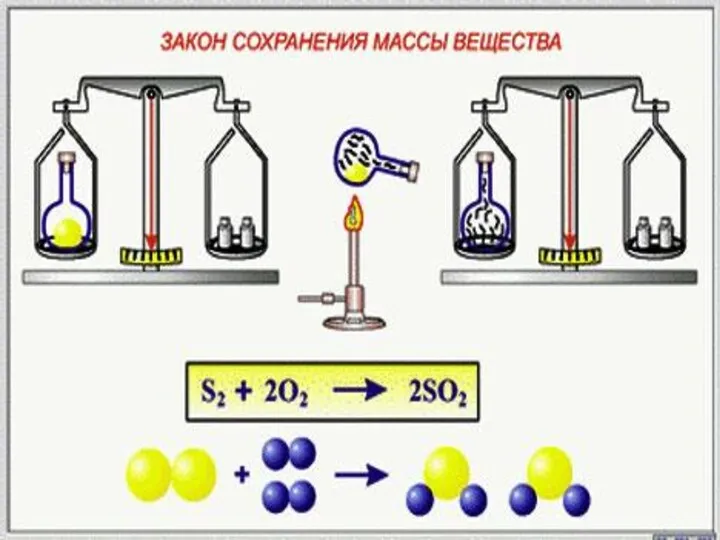
- 3. М.В.Ломоносов в 1748 г. впервые сформулировал, а в 1756 г. экспериментально доказал закон сохранения массы веществ
- 5. Формулировка закона Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
- 6. Сосуд Ландольта
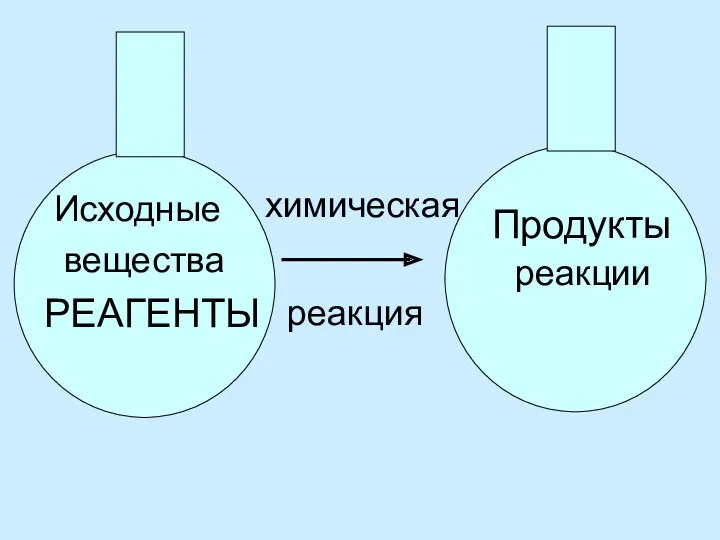
- 7. Исходные вещества РЕАГЕНТЫ химическая реакция Продукты реакции
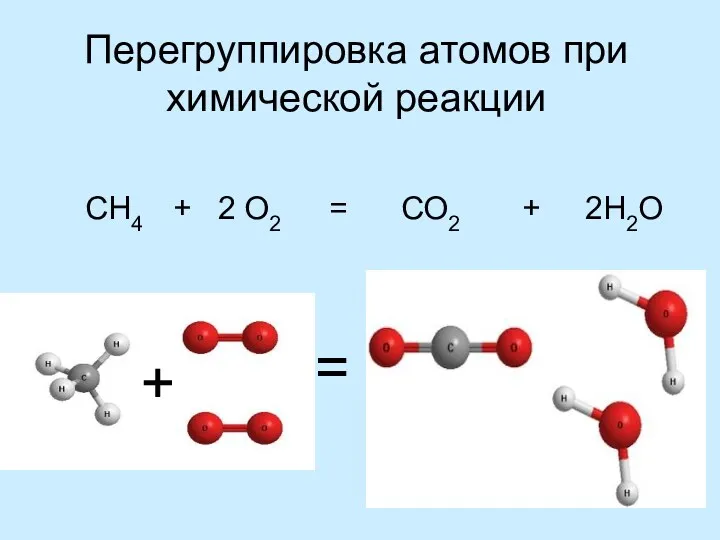
- 8. Атомы не появляются и не исчезают при химической реакции
- 9. Перегруппировка атомов при химической реакции СН4 + 2 О2 = СО2 + 2Н2О + =
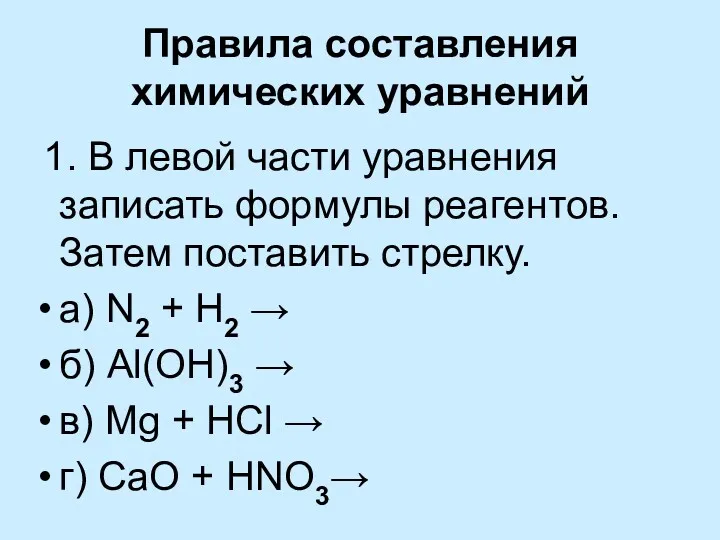
- 10. Правила составления химических уравнений 1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку. а)
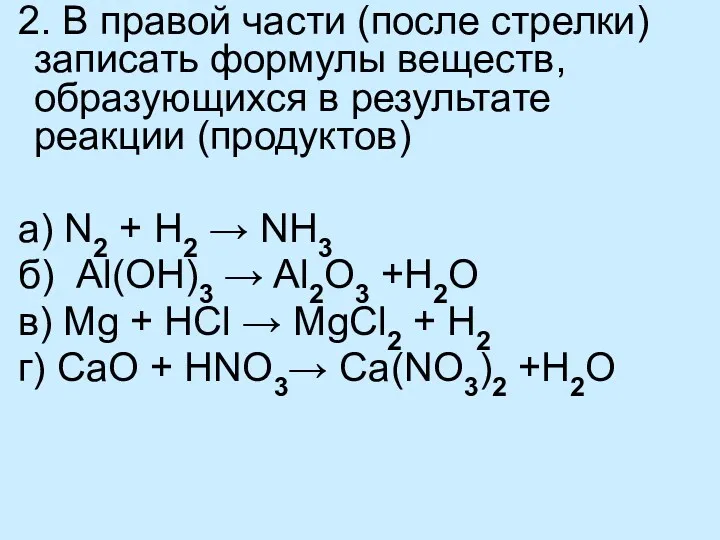
- 11. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) а) N2
- 12. 3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно
- 13. Алгоритм расстановки коэффициентов в уравнении химической реакции. 1. Подсчитать количество атомов каждого элемента в правой и
- 14. 4. Пересчитать количество атомов, при необходимости действия повторить. 5. Начинать лучше с атомов О или любого
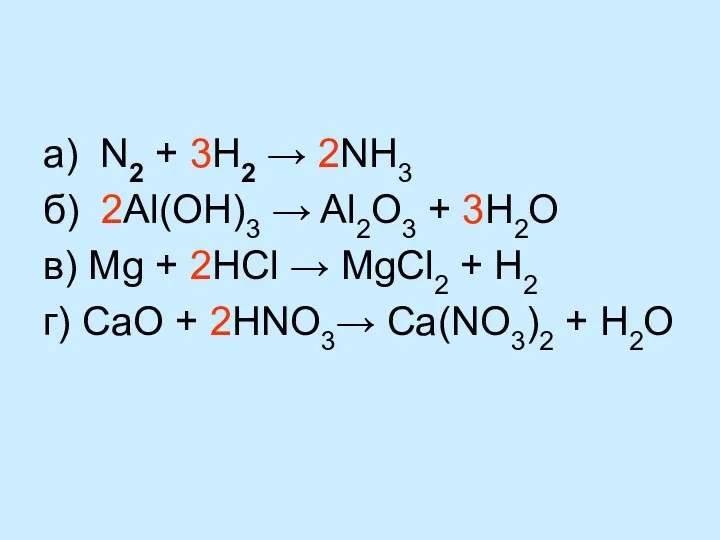
- 15. а) N2 + 3H2 → 2NH3 б) 2Al(OH)3 → Al2O3 + 3H2O в) Mg + 2HCl
- 16. Новые вещества не получаются из ничего и не могут обратиться в ничто. При химических реакциях происходит
- 18. Скачать презентацию









 Во что играют ваши дети
Во что играют ваши дети Классный час Разговор о вредных привычках
Классный час Разговор о вредных привычках Десятичные дроби. Исторический материал
Десятичные дроби. Исторический материал Инфаркт миокарда и сахарный диабет
Инфаркт миокарда и сахарный диабет Система управления химико-технологическими процессами
Система управления химико-технологическими процессами Проблемные методы в развивающем обучении дошкольников.
Проблемные методы в развивающем обучении дошкольников. Тренды 2018
Тренды 2018 Презентация к родительскому собранию Авторитет родителей.
Презентация к родительскому собранию Авторитет родителей. Пора к неврологу
Пора к неврологу Цитология – наука о клетке. Современные методы исследования
Цитология – наука о клетке. Современные методы исследования Описторхоз кезіндегі шаралар стандарттары мен алгоритмдері
Описторхоз кезіндегі шаралар стандарттары мен алгоритмдері Галузь промисловості - металургія
Галузь промисловості - металургія Эти удивительные животные
Эти удивительные животные Қазіргі әлемдегі машина жасау өнеркәсібінің дамуы
Қазіргі әлемдегі машина жасау өнеркәсібінің дамуы Пришла весна
Пришла весна Машины постоянного тока
Машины постоянного тока Презентация к уроку. Черчение - 8 класс (по А.Д.Ботвинникову). Тема урока: Общие сведения о проецировании.
Презентация к уроку. Черчение - 8 класс (по А.Д.Ботвинникову). Тема урока: Общие сведения о проецировании. Классный час Моя семья - мое богатство
Классный час Моя семья - мое богатство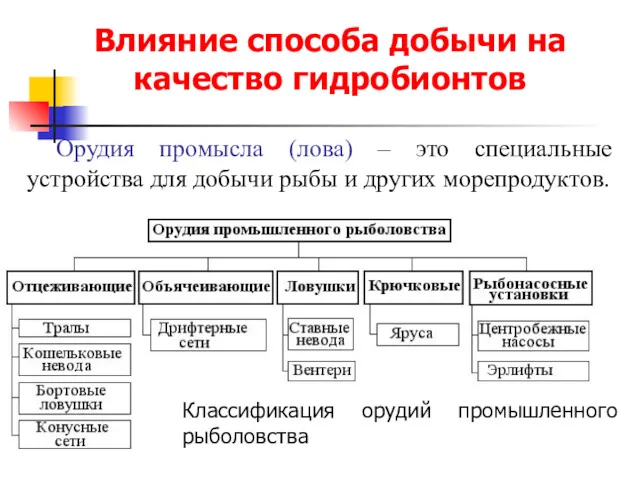 Влияние способа добычи на качество гидробионтов. Орудия промысла (лова)
Влияние способа добычи на качество гидробионтов. Орудия промысла (лова) Поздравление папы
Поздравление папы Эксплуатация электрических сетей и систем электроснабжения
Эксплуатация электрических сетей и систем электроснабжения Консультация для воспитателей Реализация ФГОС ДО в практике работы дошкольных образовательных учреждений
Консультация для воспитателей Реализация ФГОС ДО в практике работы дошкольных образовательных учреждений Шизофрения. Параноидная форма. Аспекты клиники, этиологии и патогенеза
Шизофрения. Параноидная форма. Аспекты клиники, этиологии и патогенеза А.Т.Болотов-первый русский агроном
А.Т.Болотов-первый русский агроном Конспект группового занятия на тему: Дифференциация согласных звуков С - Ш
Конспект группового занятия на тему: Дифференциация согласных звуков С - Ш Тактика. Борьба с танками, бронированными машинами и противотанковыми средствами противника. (Тема 6.1)
Тактика. Борьба с танками, бронированными машинами и противотанковыми средствами противника. (Тема 6.1) Мир цветов
Мир цветов Функции современной семьи
Функции современной семьи