Проектная работа по теме: Окислительно-восстановительные реакции в окружающей среде и в организме человека “Oxidation-reduction reactions in environment and in human body” презентация
Содержание
- 2. Задачи исследования: Использование лаборатории «Архимед» в качестве мотивирующего и развивающего школьников инструмента учебно-воспитательного процесса.
- 3. Цель работы: 1)Распознать виды окислительно-восстановительных реакций. 2)Определить влияние характера среды на окислительную активность. 3)Определить влияние температуры
- 4. Влияние среды Реакции окисления-восстановления могут протекать в различных средах: в кислой(избыток Н+-ионов),нейтральной(Н2О)и щелочной(избыток гидроксид-ионов ОН- ).
- 5. Опыты по влиянию среды легко провести, взяв, например, в качестве восстановителя раствор сульфита натрия Na2SO3, а
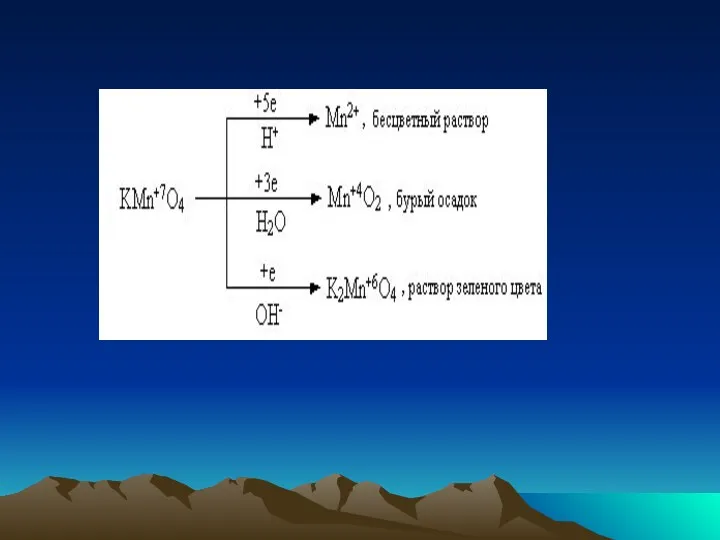
- 6. Окислительно-восстановительные реакции с участием перманганата калия В зависимости от среды (кислая, нейтральная, щелочная) перманганат калия, выступая
- 8. Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную кислоты применяют редко:
- 9. Цифровая лаборатория «Архимед» pH=6.9 T=24.44 C Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора
- 10. Изменение одного параметра – температуры, меняет ход реакции. Нагрели реакционную смесь t=+ 60 С. 3Na2 SO3+2KMnO4
- 11. pH=9 T=60 C Вывод: При повышенных температурах скорость окисления и pH повышается .
- 12. Для создания щелочной среды применяют растворы гидроксида натрия. Составим соответствующее уравнение реакций: Na2SO3+2KMnO4+2NaOH=Na2SO4+K2MnO4+ +Na2MnO4+H2O S+4-2e-=S+6 2
- 13. С помощью реакции среды можно изменить направление реакции обратимой реакции.
- 14. Нейтральная среда. 3Na2SO3+2KMnO4+H2O=3Na2SO4+2Mn02+2KOH S+4-2e-=S+6 2 3 Восст. Mn+7+3e-=Mn+4 3 2 Окислит. Фиолетовый раствор KMnO4 после окончания
- 16. pH=6.9 T=30 C При нагревании: рH =9,8 T = 64 C Вывод: при нагревание рН повышается
- 17. Значение О.В.Р Окислительно-восстановительные реакции лежат в основе «семи чудес живой и неживой природы» Фотосинтез, дыхание, гниение,
- 18. «Жизнь вулкана» сопровождается окислительно-восстановительными процессами. Например, в районах действия вулканов и на дне кратерных озер можно
- 19. Во время грозовых разрядов происходит связывание атмосферного азота Кислотные дожди…. N2+O2=2NO 2NO+O2=2NO2 2NO2+H2O=HNO3 1.Разрушает памятники 2.
- 20. О.В.Р в организме человека. Основными процессами, обеспечивающими жизнедеятельность любого организма, являются О.В.Р т.е. реакции, связанные с
- 21. Кстати, в ЮВАО окислительно-восстановительный потенциал воды составляет в среднем +210 мВ, а ВОЗ ( всемирная организация
- 22. Гемоглобин - основной дыхательный пигмент и главный компонент эритроцита, выполняющий важные функции в организме человека: перенос
- 23. Вывод: С помощью реакции среды можно изменить направление реакции. Изменением всего лишь одного параметра – температуры,
- 25. Скачать презентацию





















 Обобщение и проверка знаний по разделу О братьях наших меньших
Обобщение и проверка знаний по разделу О братьях наших меньших Социальное предпринимательство
Социальное предпринимательство Таинство причастия
Таинство причастия Разнообразие природных комплексов.
Разнообразие природных комплексов. Гендерные проблемы белорусского общества
Гендерные проблемы белорусского общества Классный час по теме Вежливость
Классный час по теме Вежливость Технология ремонта обсадных колонн стальными пластырями
Технология ремонта обсадных колонн стальными пластырями prava_i_obyazannosti_uchashchihsya_shkoly
prava_i_obyazannosti_uchashchihsya_shkoly Презентация Горные марийцы.
Презентация Горные марийцы. Замер и установка инструмента на станках с ЧПУ, коррекция инструмента
Замер и установка инструмента на станках с ЧПУ, коррекция инструмента Производственные системы и их виды
Производственные системы и их виды Электрический ток. Луиджи Гальвани. Ампер Андре Мари
Электрический ток. Луиджи Гальвани. Ампер Андре Мари Репликация ДНК. Мутации
Репликация ДНК. Мутации Первая доврачебная помощь при ДТП
Первая доврачебная помощь при ДТП Методы диагностики заболеваний органов дыхания, связанных с воздействием производственных факторов. Часть 1. Анамнез
Методы диагностики заболеваний органов дыхания, связанных с воздействием производственных факторов. Часть 1. Анамнез Государство Швейцария
Государство Швейцария Правительство РФ. Тема 15
Правительство РФ. Тема 15 Проект Скучно на уроке
Проект Скучно на уроке Интерактивная физкультминутка Чунга-Чанга
Интерактивная физкультминутка Чунга-Чанга Коллективный договор
Коллективный договор Intel Core I7 негізіндегі компьютерлік архитектура
Intel Core I7 негізіндегі компьютерлік архитектура Флексографический способ печати
Флексографический способ печати Первая мировая война 1914-1918
Первая мировая война 1914-1918 Атлантический океан
Атлантический океан 5 фактов об Огненной дуге
5 фактов об Огненной дуге Внеклассное мерприятие Особенности поведения зимой в лесу
Внеклассное мерприятие Особенности поведения зимой в лесу Викторина по произведениям С. Я. Маршака
Викторина по произведениям С. Я. Маршака Разработка грунта землеройно-транспортными машинами
Разработка грунта землеройно-транспортными машинами