Содержание
- 2. ПЛАН ЛЕКЦИИ Принцип метода Кривые титрования для сильных и слабых кислот (оснований). Выбор кислотно-основного индикатора. Применение
- 3. ОСНОВНЫЕ ПОНЯТИЯ Титрование (титриметрия) (от франц. titre — качество, характеристика) — метод количественного анализа, основанный на
- 4. ВАРИАНТЫ МЕТОДА НЕЙТРАЛИЗАЦИИ Растворители: вода, спирты, ледяная уксусная кислота, амины, ацетон, диметилформамид, диметилсульфоксид, жидкий аммиак
- 5. МЕТОД НЕЙТРАЛИЗАЦИИ Принцип метода : Н+ + ОН- = Н2О Реакция нейтрализации характеризуется высокой скоростью, протекает
- 6. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ТИТРАНТОВ В качестве титрантов выступают растворы кислот или оснований. Растворы кислот более устойчивы, могут
- 7. СТАНДАРТИЗАЦИЯ РАСТВОРОВ ТИТРАНТОВ Стандартизацию растворов кислот проводят по тетраборату натрия: карбонату натрия: Стандартизацию оснований проводят по
- 8. КРИВЫЕ ТИТРОВАНИЯ В методе нейтрализации - это зависимость рН титруемого раствора от объема добавленного титранта, v,
- 9. после т.экв. f > 1 14 – (рС - lg(f –1) ) сильное основание в т.экв.
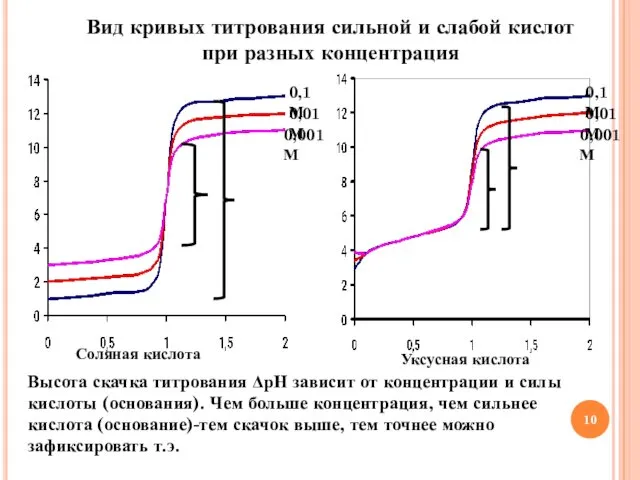
- 10. Вид кривых титрования сильной и слабой кислот при разных концентрация Соляная кислота Уксусная кислота Высота скачка
- 11. Титрование смесей протолитов (или многопротонных протолитов) рКa + рС ≤ 8 рКb + рС ≤ 8
- 12. ТИТРОВАНИЕ СМЕСЕЙ ОДНОТИПНЫХ ПРОТОЛИТОВ При добавлении титранта к смеси протолитов первым оттитровывается более сильный протолит. Критерий
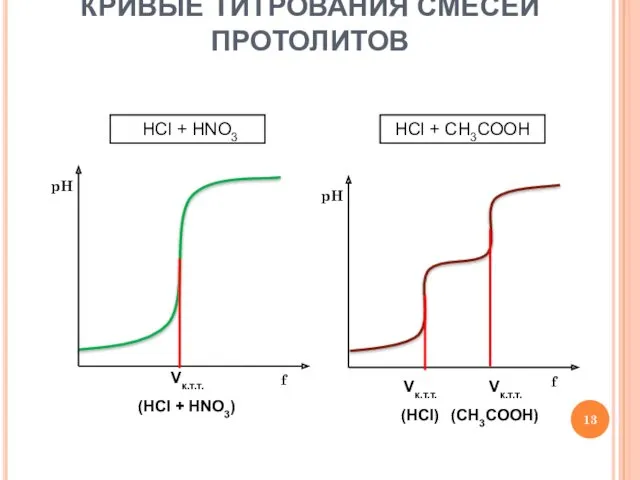
- 13. КРИВЫЕ ТИТРОВАНИЯ СМЕСЕЙ ПРОТОЛИТОВ Vк.т.т. (HCl + HNO3) НСl + HNO3 Vк.т.т. (HCl) Vк.т.т. (CH3COOH) НСl
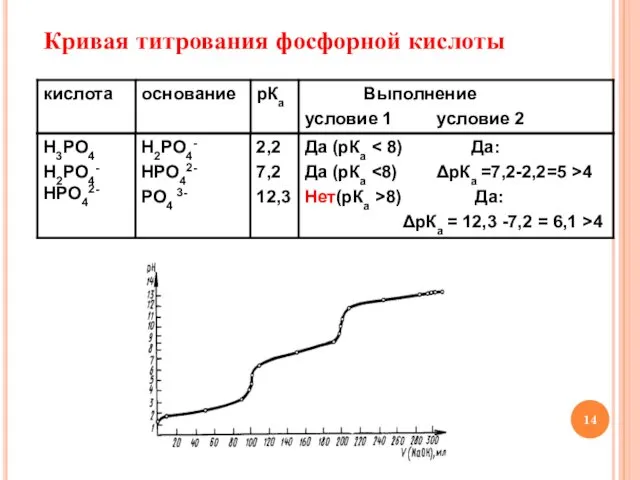
- 14. Кривая титрования фосфорной кислоты
- 15. Кислотно-основные индикаторы – органические соединения, которые меняют окраску в зависимости от рН раствора ИНДИКАТОРЫ HInd H+
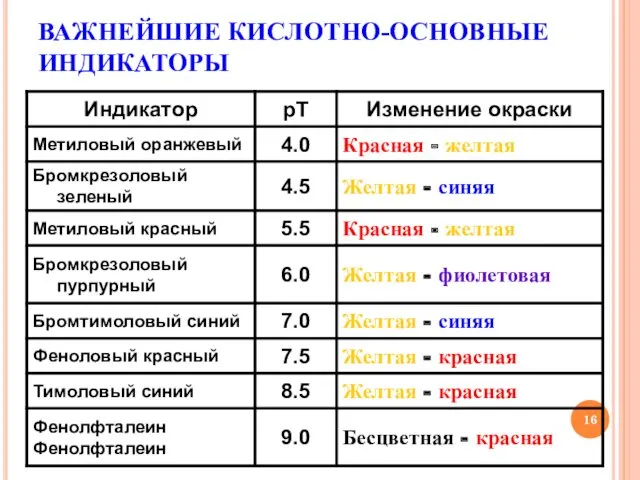
- 16. ВАЖНЕЙШИЕ КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ
- 17. ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ Его проводят, когда: - вещество не растворяется в воде - разлагается водой
- 18. Если титруют одно вещество для усиления его кислотно-основных свойств выбирают растворитель с противоположной функцией для улучшения
- 19. ЕСЛИ ТИТРУЮТ СМЕСЬ ВЕЩЕСТВ можно выбрать нивелирующий растворитель (с противоположной функцией), тогда оттитровывают смесь разом, т.е.
- 20. Химические реакции при титровании анилина (рКb =9,2) хлорной кислотой в среде уксусной кислоты в анализируемом растворе:
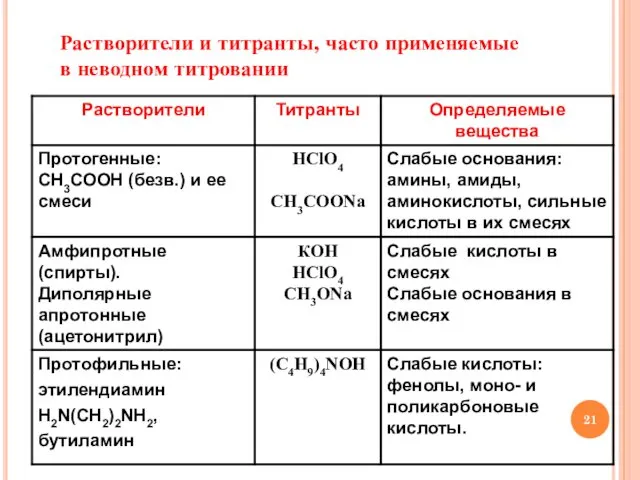
- 21. Растворители и титранты, часто применяемые в неводном титровании
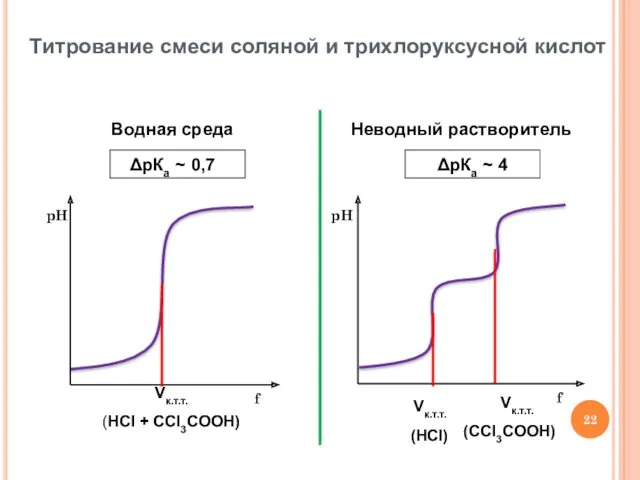
- 22. Титрование смеси соляной и трихлоруксусной кислот Водная среда Неводный растворитель Vк.т.т. (HCl + ССl3COOH) Vк.т.т. (HCl)
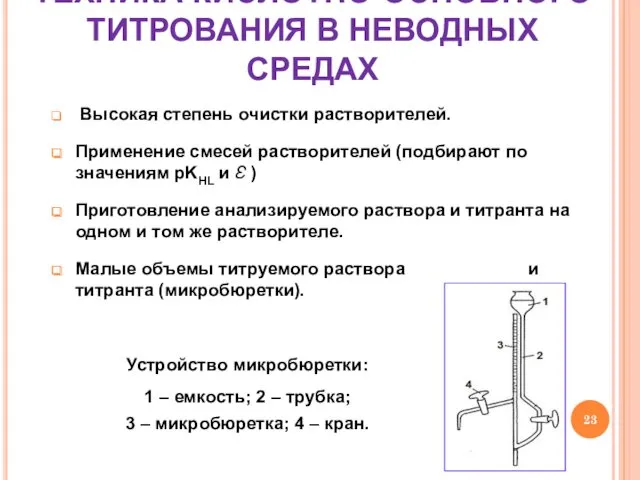
- 23. ТЕХНИКА КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ В НЕВОДНЫХ СРЕДАХ Высокая степень очистки растворителей. Применение смесей растворителей (подбирают по значениям
- 25. Скачать презентацию















 дорога жизни
дорога жизни Современное состояние и развитие рынка пассажирских перевозок
Современное состояние и развитие рынка пассажирских перевозок Арифметико-логические устройства, микропроцессоры
Арифметико-логические устройства, микропроцессоры Способы защиты права собственности и других вещных прав
Способы защиты права собственности и других вещных прав Скорость передачи информации
Скорость передачи информации Управление качеством в допечатной подготовке
Управление качеством в допечатной подготовке Техническое обслуживание автомобиля. (Часть 1)
Техническое обслуживание автомобиля. (Часть 1) Устройство железнодорожного пути. Земляное полотно
Устройство железнодорожного пути. Земляное полотно Макрорегионы США
Макрорегионы США Микеланджело Буонарроти (1475 – 1564)
Микеланджело Буонарроти (1475 – 1564) Комплексный проект как интеграция общего и дополнительного образования в условиях замкнутого социума
Комплексный проект как интеграция общего и дополнительного образования в условиях замкнутого социума Споконвіку було Слово, і слово було у Бога, і Слово було Бог. Єв. Івана гл.1.1
Споконвіку було Слово, і слово було у Бога, і Слово було Бог. Єв. Івана гл.1.1 Война в истории семьи Литовченко Ивана Егоровича
Война в истории семьи Литовченко Ивана Егоровича Приёмы сложения однозначных чисел с переходом через десяток
Приёмы сложения однозначных чисел с переходом через десяток Моя малая Родина. Я-законопослушный пешеход
Моя малая Родина. Я-законопослушный пешеход Китай
Китай Сызранский краеведческий музей
Сызранский краеведческий музей Патофізіологія системи крові. (Лекція 10)
Патофізіологія системи крові. (Лекція 10) Техника безопасности при работе с электроприборами
Техника безопасности при работе с электроприборами Рак вульвы
Рак вульвы Определение коэффициента нефтегазонасыщенности. Определение эффективной нефтенасыщенной мощности
Определение коэффициента нефтегазонасыщенности. Определение эффективной нефтенасыщенной мощности Геофизические методы разведки нефтяных и газовых месторождений
Геофизические методы разведки нефтяных и газовых месторождений 8 класс. Природные комплексы русской равнины
8 класс. Природные комплексы русской равнины Возбуждение и рассмотрение дела об административном правонарушении
Возбуждение и рассмотрение дела об административном правонарушении История Интернет
История Интернет ВРТ вчера, сегодня завтра: общемировой опыт ЭКО
ВРТ вчера, сегодня завтра: общемировой опыт ЭКО Multiple Choice Beginner Game
Multiple Choice Beginner Game Наименьшее общее кратное. 6 класс,
Наименьшее общее кратное. 6 класс,