Содержание
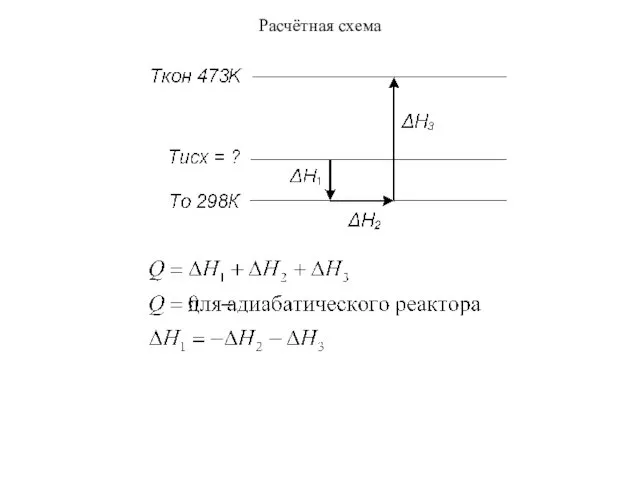
- 2. Расчёт удобно проводить по схеме, приведённой на рисунке: Hисх + ΔH1 + ΔH2 + ΔH3 =
- 3. Будем считать, что ΔН 0, если тепло поглощается системой. В качестве стандартной температуры удобно использовать температуру
- 4. Если сpi= const, то: где Q1 – тепло, выделяемое при охлаждении исходной смеси от температуры Tисх
- 5. 2. Расчёт ΔH2 (Q3 >0 или где M – число линейно независимых химических реакций; ΔHik- тепловой
- 6. где vij - стехиометрический коэффициент при компоненте j в реакции i для продуктов и исходных веществ;
- 7. Если сpi= const, то: где Q4 – тепло, необходимое для нагревания исходной смеси от температуры To
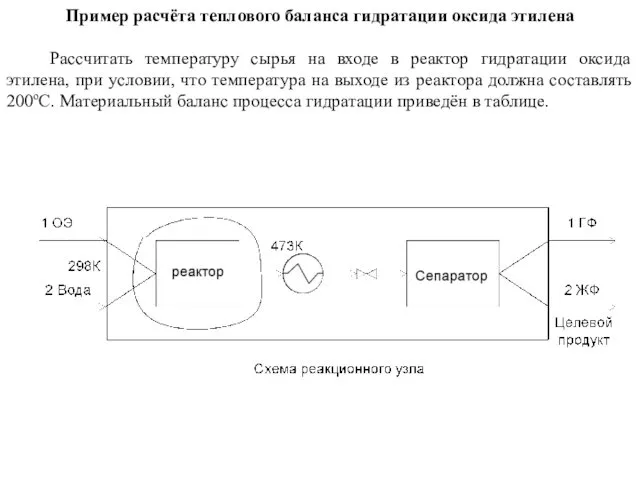
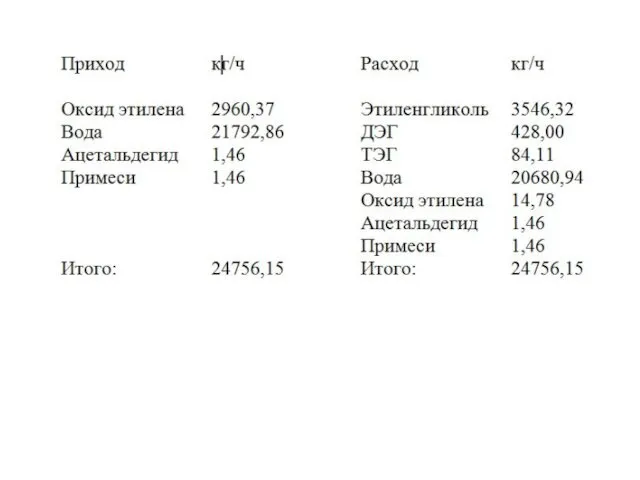
- 8. Пример расчёта теплового баланса гидратации оксида этилена Рассчитать температуру сырья на входе в реактор гидратации оксида
- 10. Расчётная схема
- 11. 1. Расчёт изменения энтальпии при химическом превращении Реакции: Теплоты образования компонентов, Нi (ккал/моль):
- 12. Тепловые эффекты химических реакций, (ккал/моль): Тепловые эффекты химических реакций, (ккал/кг продукта):
- 13. Изменение энтальпии при химических превращениях ΔН2: 2. Расчёт изменения энтальпии при нагреве продуктов от температуры 298К
- 14. 3. Находим ΔН1 – энтальпия охлаждения от Тнач. до 298оС:
- 16. Скачать презентацию










 Дидактика высшей школы. Формирование системы знаний о дидактике, как отрасли педагогики
Дидактика высшей школы. Формирование системы знаний о дидактике, как отрасли педагогики Евгеника, как форма решения качества и количества людей
Евгеника, как форма решения качества и количества людей Стандартный вид числа
Стандартный вид числа Современные модели образовательного процесса ДОУ
Современные модели образовательного процесса ДОУ Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Дееспособность несовершеннолетних
Дееспособность несовершеннолетних Польща в 1918-1939 роках
Польща в 1918-1939 роках Радіометричні поліпшуючі перетворення. Лабораторна робота №19
Радіометричні поліпшуючі перетворення. Лабораторна робота №19 Европейский Юг
Европейский Юг Николай I
Николай I Компоновочно-планировочные решения механосборочных цехов и участков. (Тема 10)
Компоновочно-планировочные решения механосборочных цехов и участков. (Тема 10) Структура персонального компьютера. 10 класс
Структура персонального компьютера. 10 класс Ученик года - 2017
Ученик года - 2017 Электронные таблицы Microsoft Excel
Электронные таблицы Microsoft Excel Ветеринарно-санитарная оценка кормов для промышленного производства
Ветеринарно-санитарная оценка кормов для промышленного производства Свободное падение. Тесты
Свободное падение. Тесты Поделка Курица. Мастер-класс
Поделка Курица. Мастер-класс Контакт: металл - полупроводник
Контакт: металл - полупроводник Основы христианской культуры в духовной жизни народа
Основы христианской культуры в духовной жизни народа Корпоративні інформаційні системи. Лекція 2
Корпоративні інформаційні системи. Лекція 2 Взаимодействие взрослых и детей при создании кукол кувадок
Взаимодействие взрослых и детей при создании кукол кувадок Иван Иванович Шишкин
Иван Иванович Шишкин Интеллектуальный марафон - 4 (2 класс)
Интеллектуальный марафон - 4 (2 класс) TPR метод в обучении иностранному языку
TPR метод в обучении иностранному языку Звук. Слово
Звук. Слово Этапы развития ОАО Нафтан
Этапы развития ОАО Нафтан Презентация Откуда пришла книга
Презентация Откуда пришла книга Выразительные средства в произведениях русских поэтов. Владимир Владимирович Маяковский (1893 - 1930)
Выразительные средства в произведениях русских поэтов. Владимир Владимирович Маяковский (1893 - 1930)