Содержание
- 2. План лекции 1. Диссоциация воды, ионное произведение воды. Водородный показатель. Шкала рН растворов. 2. Гидролиз солей.
- 3. П.1. Диссоциация воды, ионное произведение воды. Водородный показатель. Шкала рН растворов. 3
- 4. Ионное произведение воды H+ H2O + H2O ⮀ H3O+ + OH– H3O+ - гидроксоний H2O ⮀
- 5. Водородный показатель (рН) Отрицательный десятичный логарифм концентрации ионов водорода рН = –lg[H+] = –lg10-7 = 7
- 6. Водородный показатель (рН) В чистой воде при 25°С рН = рОН = 7, среда нейтральная В
- 7. Шкала рН При [H+] = 0,1 моль/л (например, в 0,1 М растворе HCl) pH = 1
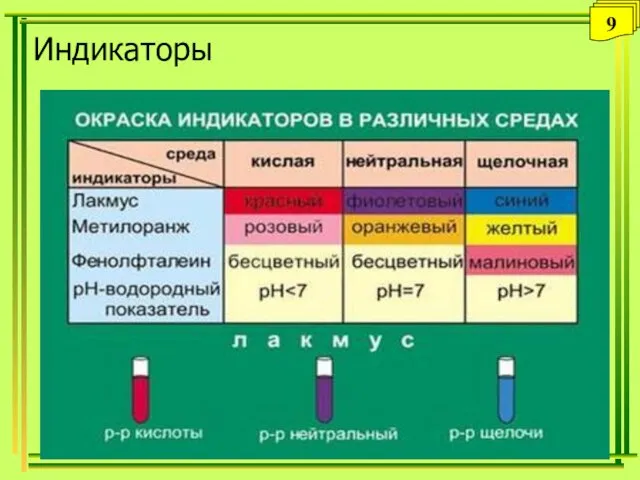
- 8. Кислотно-основные индикаторы Вещества, которые обратимо изменяют свою окраску в зависимости от рН раствора. Это слабые органические
- 9. Индикаторы 9
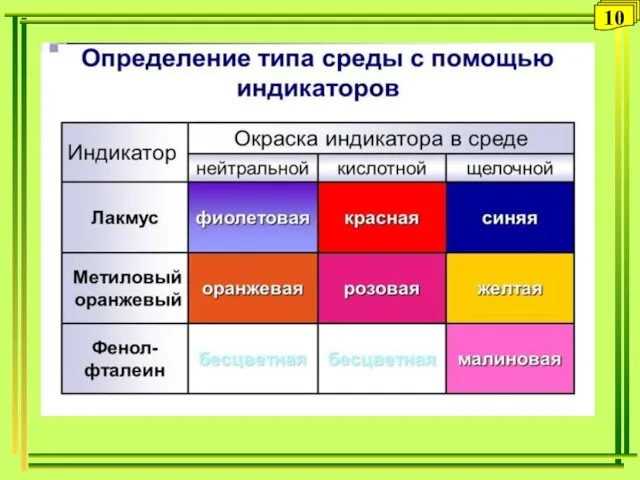
- 10. 10
- 11. 11
- 12. Значение рН
- 13. П2. Гидролиз солей 13
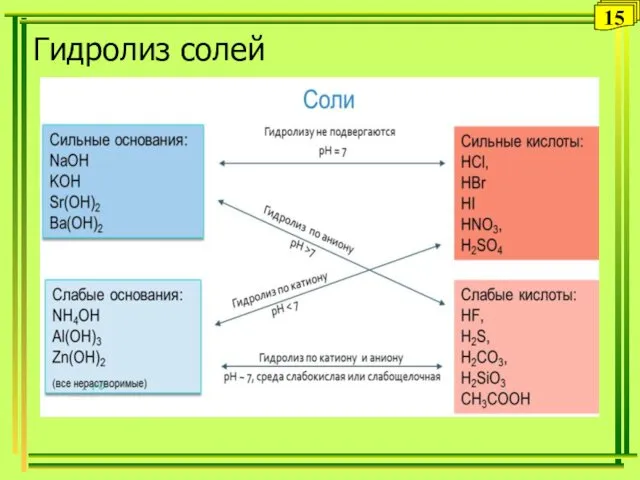
- 14. Гидролиз 14 Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными
- 15. Гидролиз солей 15
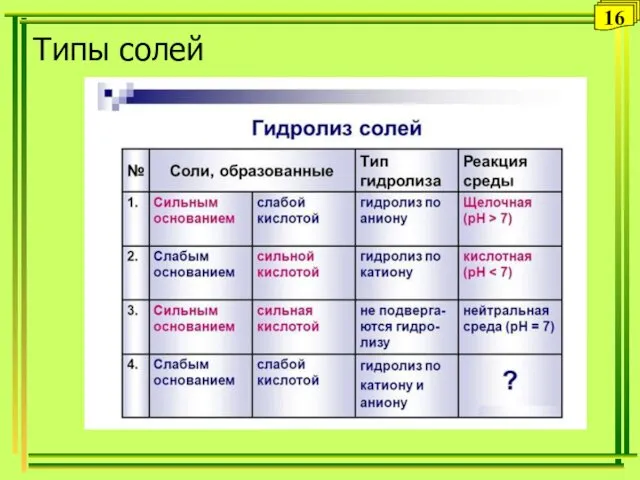
- 16. Типы солей 16
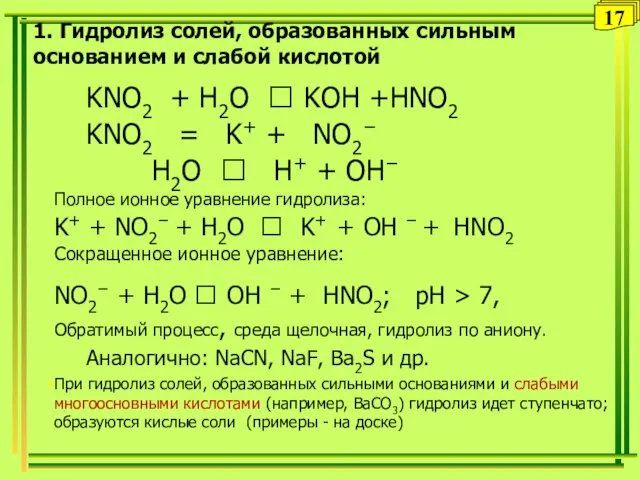
- 17. 1. Гидролиз солей, образованных сильным основанием и слабой кислотой KNO2 + H2O ⮀ KOH +HNO2 KNO2
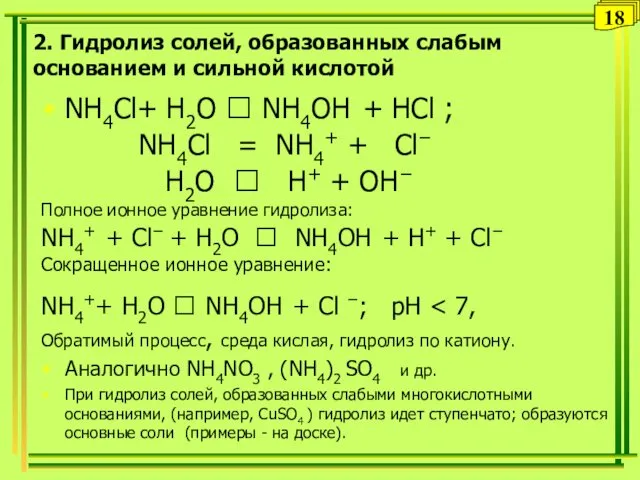
- 18. 2. Гидролиз солей, образованных слабым основанием и сильной кислотой NH4Сl+ H2O ⮀ NH4OH + НCl ;
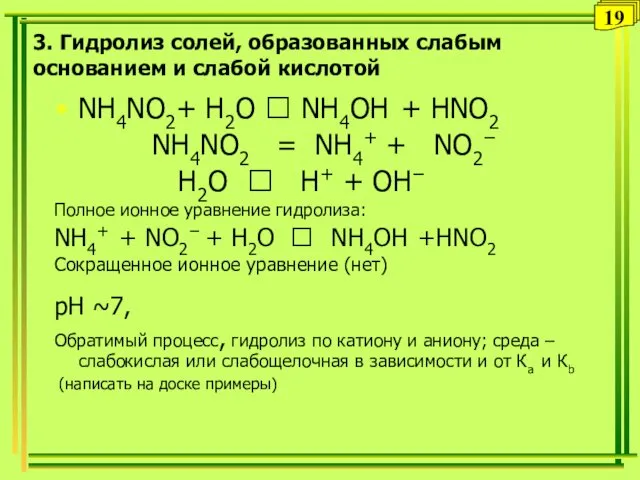
- 19. 3. Гидролиз солей, образованных слабым основанием и слабой кислотой NH4NO2+ H2O ⮀ NH4OH + НNO2 NH4NO2
- 20. Необратимый совместный гидролиз 2AlCl3 + 3Na2S + 6H2O = = 2Al(OH)3↓ + 3H2S↑ + 6NaCl 2Al3+
- 21. Определение рН водных растворов 21
- 22. 22
- 23. П.4. Реакции ионного обмена, условия их протекания. Порядок составления ионных уравнений. Реакции, протекающие между ионами, называются
- 24. Вопросы к экзамену по общей и неорганической химии 1. Понятия: материя, вещество. Предмет науки химия 2.
- 26. Скачать презентацию





![Шкала рН При [H+] = 0,1 моль/л (например, в 0,1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/37032/slide-6.jpg)










 Эмоционально-волевая сфера личности
Эмоционально-волевая сфера личности Космическое путешествие
Космическое путешествие Значение, задачи и методический инструментарий экономического анализа
Значение, задачи и методический инструментарий экономического анализа Василь-Костянтин Острозький. Український православний князь, культурно-освітній діяч
Василь-Костянтин Острозький. Український православний князь, культурно-освітній діяч Самостійна робота студента
Самостійна робота студента Инструменты для обработки отверстий. Часть 2
Инструменты для обработки отверстий. Часть 2 Становление парламентаризма
Становление парламентаризма Октановое и цетановое числа
Октановое и цетановое числа Угрозы, риски и последствия развития искусственного интеллекта
Угрозы, риски и последствия развития искусственного интеллекта Правила поведения в группе продленного дня презентация
Правила поведения в группе продленного дня презентация Дворец Халифа Хишама в Израиле
Дворец Халифа Хишама в Израиле Свойства почвы
Свойства почвы Исследовательские проеты
Исследовательские проеты Принципы организации производственного процесса и типы производств
Принципы организации производственного процесса и типы производств Разборка ноутбук Lenovo G580
Разборка ноутбук Lenovo G580 Литературное чтение. 3 класс
Литературное чтение. 3 класс Конкурс Отгадай слово. Презентация
Конкурс Отгадай слово. Презентация Искусственный интеллект
Искусственный интеллект Будущее образования: глобальная повестка
Будущее образования: глобальная повестка Modern machine tools
Modern machine tools Л 1 Числ множ Предел последов
Л 1 Числ множ Предел последов Проект системы освещения жилого дома
Проект системы освещения жилого дома Ғылыми экспериментті жүргізу тәртібі және экспериментаторға қойылатын талаптар туралы
Ғылыми экспериментті жүргізу тәртібі және экспериментаторға қойылатын талаптар туралы Выпускная квалификционная работа : Организационное проектирование управления персоналом организации
Выпускная квалификционная работа : Организационное проектирование управления персоналом организации Технология приготовления булочных и сдобных изделий из пшеничной муки
Технология приготовления булочных и сдобных изделий из пшеничной муки Мясные консервы
Мясные консервы Компьютер! Интернет! Да или нет?
Компьютер! Интернет! Да или нет? Сущность предварительного напряжения бетона
Сущность предварительного напряжения бетона