Содержание
- 2. Задача № 1. В каком объемном соотношении необходимо смешать водород и углекислый газ, чтобы получить газовую
- 3. Способ № 1. Количество вещества. Введение двух неизвестных. (x и y)
- 4. Способ № 2. Количество вещества (одно неизвестное)
- 5. H2 2 15 воздух 29 СO2 44 27 Ответ: CO2 – 27 частей H2 – 15
- 6. 96% 30:2=15массовых частей 40% 10% 56:2=28 массовых частей на 15 массовых частей 96% серной кислоты нужно
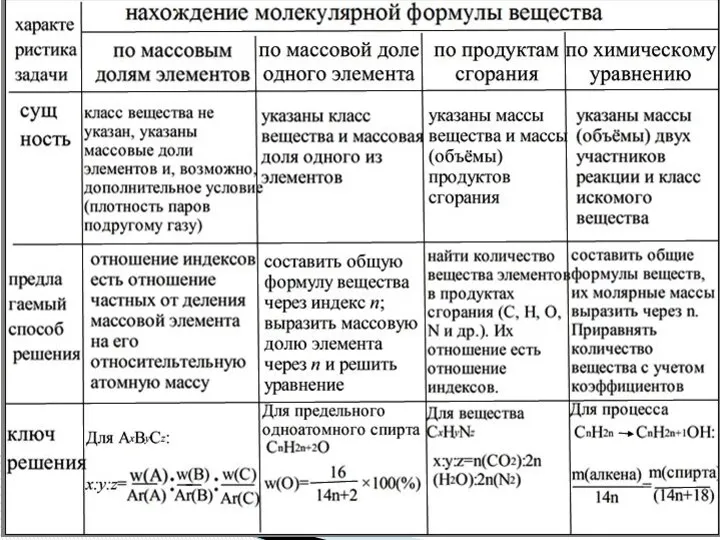
- 7. Разновидности задач на нахождение молекулярной формулы вещества
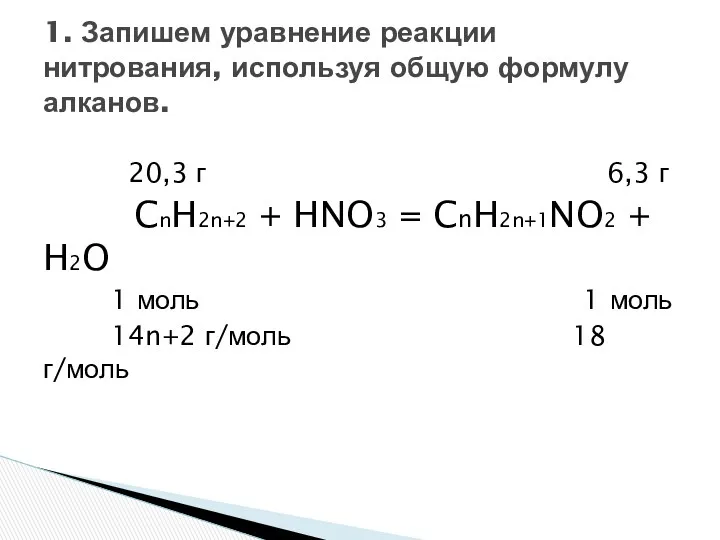
- 9. При мононитровании 20,3 г. алкана выделилось 6,3 г. воды. Какой объем воздуха, измеренный при н.у., потребуется
- 10. 20,3 г 6,3 г CnH2n+2 + HNO3 = CnH2n+1NO2 + H2O 1 моль 1 моль 14n+2
- 11. 2. Найдем количество вещества выделившийся при нитровании воды.
- 12. n(CnH2n+2) = n(H2O) = 0,35 моль 3. По уравнению реакции найдем количество вещества прореагировавшего алкана.
- 13. 4. Найдем молекулярную массу прореагированного алкана.
- 14. 0,35 моль x моль 2C4H10 + 13O2 = 8CO2 + 10H2O 2 моль 13 моль n(O2)
- 15. 7. Вычисляем объем затраченного на горение кислорода.
- 16. 8. Найдем объем воздуха, содержащего необходимое количество кислорода.
- 18. Скачать презентацию













 Введение в послание ап. Павла к Римлянам
Введение в послание ап. Павла к Римлянам Қазақстан территориясындағы ислам діні
Қазақстан территориясындағы ислам діні Издержки и прибыль фирмы. Рынок и рыночный механизм. (Тема 5-6)
Издержки и прибыль фирмы. Рынок и рыночный механизм. (Тема 5-6) Один - много. Игрушки
Один - много. Игрушки Las artes visuales después de 1980 posmodernidad
Las artes visuales después de 1980 posmodernidad БЕЗЗАВЕТНОЕ Служение Церкви и людям нашего современника митрофорного протоиерея Георгия Трубицына
БЕЗЗАВЕТНОЕ Служение Церкви и людям нашего современника митрофорного протоиерея Георгия Трубицына Культурный код Развитие. Концепция благоустройства общественного центра поселка Балезино
Культурный код Развитие. Концепция благоустройства общественного центра поселка Балезино Наш дружный комитет! Портфолио Родительского комтета
Наш дружный комитет! Портфолио Родительского комтета Физиология лактации
Физиология лактации Изменение фармакокинетики ЛС при заболеваниях печени и почек
Изменение фармакокинетики ЛС при заболеваниях печени и почек История авто Subaru Impreza
История авто Subaru Impreza Религия как социокультурный феномен
Религия как социокультурный феномен Многообразие культур и способы их изучения
Многообразие культур и способы их изучения Изгибаемые элементы
Изгибаемые элементы Храм Казанской иконы Божией Матери села Большая Шорманга Череповецкого района
Храм Казанской иконы Божией Матери села Большая Шорманга Череповецкого района Bunker Sampling
Bunker Sampling Морфологический разбор имени прилагательного
Морфологический разбор имени прилагательного Женевские переговоры по Сирии, 2016 год
Женевские переговоры по Сирии, 2016 год Сочинение по картине А.В. Сайкиной Детская спортивная школа
Сочинение по картине А.В. Сайкиной Детская спортивная школа Полка для инструментов
Полка для инструментов Презентация к родительскому собранию в форме игры Счастливый случай
Презентация к родительскому собранию в форме игры Счастливый случай Одноковшовый экскаватор
Одноковшовый экскаватор До и после чернобыльской аварии
До и после чернобыльской аварии Наволочка с клапаном. Обработка поперечных срезов наволочки
Наволочка с клапаном. Обработка поперечных срезов наволочки Машинные швы. Требования к машинным швам. 6 класс
Машинные швы. Требования к машинным швам. 6 класс Мастер-класс Бабочка
Мастер-класс Бабочка Жизнь на материке Африка.
Жизнь на материке Африка. Блокированный дом на 2 семьи
Блокированный дом на 2 семьи