Содержание
- 2. Комплексные соединения: история открытия и изучения
- 3. История открытия и изучения Одним из первых описанных соединений такого типа были желтая и красная кровяные
- 4. Теория Вернера: термины Комплексообразователь (центральный атом) – ион или нейтральный атом металла со свободными электронными ячейками;
- 5. Образование комплексной частицы Связи между ЦА и лигандами могут быть как электростатическими, так и обр. по
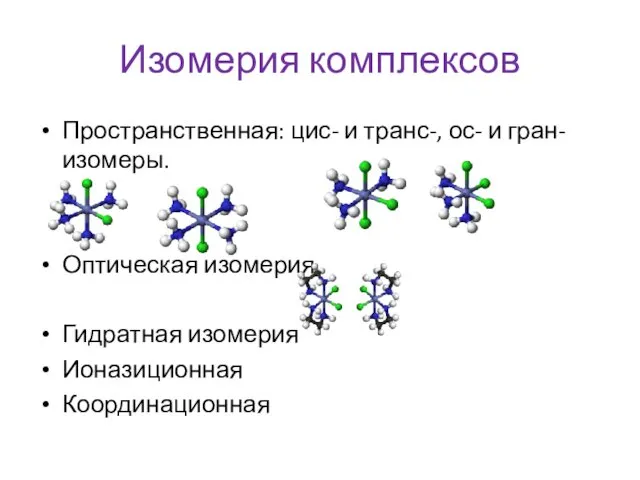
- 6. Изомерия комплексов Пространственная: цис- и транс-, ос- и гран- изомеры. Оптическая изомерия Гидратная изомерия Ионазиционная Координационная
- 7. Номенклатура комплексных соединений Лиганды перечисляются в последовательности от отрицательных (с добавлением -о) к нейтральным и положительным;
- 8. Реакции комплексных соединений Вступают в реакции: Обмена ионами внешней сферы; Обмена лигандами; Окисления (ЦА); Разрушения и
- 9. Примеры реакций комплексных соединений
- 10. Разрушение и получение аквакомплексов При нагревании твердых кристаллогидратов аквакомплекс рушится и изменяется цвет солей: CuSO4*5H2O =
- 11. Получение гидроксокомплексов Соли амфотерных металлов способны давать растворимые комплексы в избытке щелочи: Al3+ + 6 OH-
- 12. Получение аммиакатов Многие металлы образуют комплексные соединения с аммиаком. Al3+, Pb2+ - не дают аммиакатов! Zn2+
- 13. Цианоферратные комплексы Получение «берлинской лазури» или «турнбулевой сини»: Fe2+ + K3[Fe(CN)6] = KFe[Fe(CN)6] + 2K+ Fe3+
- 14. Образование роданидных комплексов Роданид-анион способен к образованию прочных соединений с ионами кобальта-II и железа-III: Fe3+ +
- 15. Разрушение роданидных комплексов Довольно прочный комплекс железа разрушается фторид-ионами: [Fe(NCS)3] + 6 NaFтв. = Na3[FeF6] +
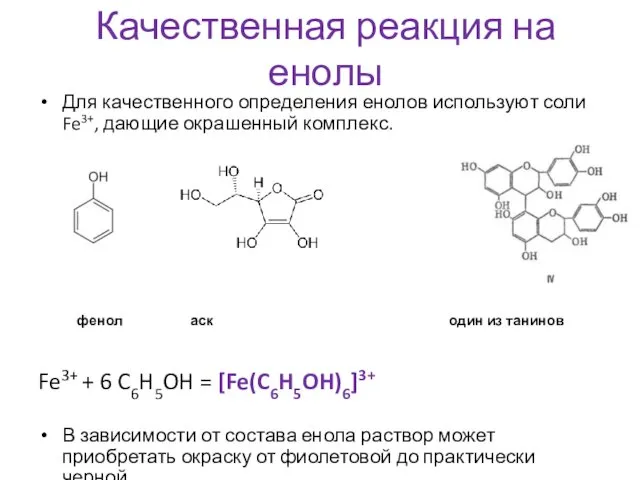
- 16. Качественная реакция на енолы Для качественного определения енолов используют соли Fe3+, дающие окрашенный комплекс. фенол аскорбиновая
- 17. Комплексы с ДМГО Качественная специфичная реакция на Ni2+ с диметилглиоксимом (ДМГО) – реактивом Чугаева. Подобную реакцию
- 18. Получение хлоридного комплекса меди-II Гидрат-ион меди-II способен замещать воду в КС на хлорид-ионы при высокой их
- 19. Получение гликолята меди-II Ион меди-II способен реагировать в сильнощелочной среде с гликолями (вицинальными диолами), например –
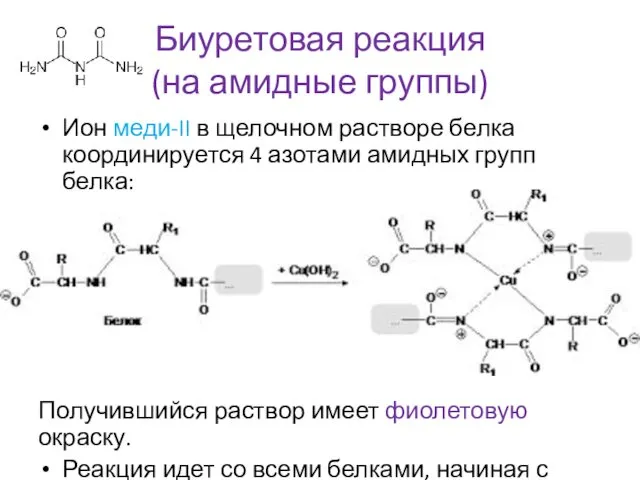
- 20. Биуретовая реакция (на амидные группы) Ион меди-II в щелочном растворе белка координируется 4 азотами амидных групп
- 21. Качественная реакция на ион калия Для определения она калия в растворе используют кобальтинитрит натрия: 3 K+
- 22. Качественная реакция на кислород Соединения меди-I неустойчивы на воздухе и легко окисляются кислородом воздуха. На окислении
- 23. Получение надхромовой кислоты Соединения Cr +6 могут образовывать надхромовую кислоту в реакциях с перекисью водорода. Эта
- 25. Скачать презентацию












![Разрушение роданидных комплексов Довольно прочный комплекс железа разрушается фторид-ионами: [Fe(NCS)3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42371/slide-14.jpg)






 Создание проекта по обработке изображения
Создание проекта по обработке изображения Презентация Мини-музея Игрушки
Презентация Мини-музея Игрушки Формирование жилой застройки
Формирование жилой застройки Презентация Туберкулез - чума 21 века
Презентация Туберкулез - чума 21 века Всемирные экономические отношения. 10 класс
Всемирные экономические отношения. 10 класс Учебно-исследовательская работа. Роль фортепиано в моей жизни
Учебно-исследовательская работа. Роль фортепиано в моей жизни презентация Юнгианский подход.Песочная терапия
презентация Юнгианский подход.Песочная терапия Причины возникновения экологических проблем в городе
Причины возникновения экологических проблем в городе Правовые основы защиты персональных данных. Права обладателя персональных данных
Правовые основы защиты персональных данных. Права обладателя персональных данных Интерактивный тест: Техника и технология ручной дуговой сварки покрытыми электродами
Интерактивный тест: Техника и технология ручной дуговой сварки покрытыми электродами Элементы токсикометрии и критерии токсичности ядов
Элементы токсикометрии и критерии токсичности ядов Условия которые необходимо создать в семье для развития речи ребёнка. Советы логопеда
Условия которые необходимо создать в семье для развития речи ребёнка. Советы логопеда Примеры комбинаторных задач
Примеры комбинаторных задач Изыскание и проектирование
Изыскание и проектирование Что такое туберкулез?
Что такое туберкулез? Общие сведения о видах надзора и контроля в сфере безопасности
Общие сведения о видах надзора и контроля в сфере безопасности Презентация Животный мир лесной зоны
Презентация Животный мир лесной зоны Организация амбулаторной хирургической службы
Организация амбулаторной хирургической службы Независимые события
Независимые события Поделки из пластилина 1 класс.
Поделки из пластилина 1 класс. Психосоциальная характеристика профессиональной деформации социальных работников: технологии преодоления
Психосоциальная характеристика профессиональной деформации социальных работников: технологии преодоления Обследование и формирование речи дошкольников и младших школьников (часть I)
Обследование и формирование речи дошкольников и младших школьников (часть I) Интернет-магазин экологически чистых товаров EcoFutureShop • EFS
Интернет-магазин экологически чистых товаров EcoFutureShop • EFS Обследование и благоустройство родников на территории села Шпикулово и их охрана
Обследование и благоустройство родников на территории села Шпикулово и их охрана uzniki_kontslagerey_slayd_1-12
uzniki_kontslagerey_slayd_1-12 День защитника Отечества
День защитника Отечества Виды и геометрические характеристики оперения и рулей. Шарнирный момент
Виды и геометрические характеристики оперения и рулей. Шарнирный момент Spotlight-3. Module 7. Unit 13a -3b. “We’re having a great time”
Spotlight-3. Module 7. Unit 13a -3b. “We’re having a great time”