Содержание
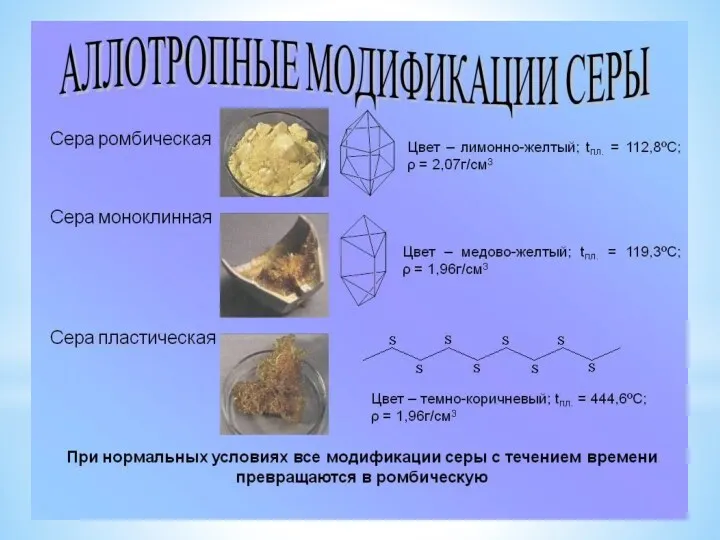
- 2. Историческая справка Сера в самородном состоянии, а также в виде соединений, например сульфидов, известна с древнейших
- 4. Получение 1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода
- 5. Химические свойства Окислительные свойства серы (S0 + 2ē → S-2) 1) Сера реагирует со щелочными металлами
- 6. 2) c кислородом: S + O2 –t°→ S+4O2 2S + 3O2 –t°;pt→ 2S+6O3 3) c галогенами
- 7. ОКСИДЫ СЕРЫ Оксид серы IV SO2 (сернистый ангидрид; сернистый газ) Бесцветный газ с резким запахом; хорошо
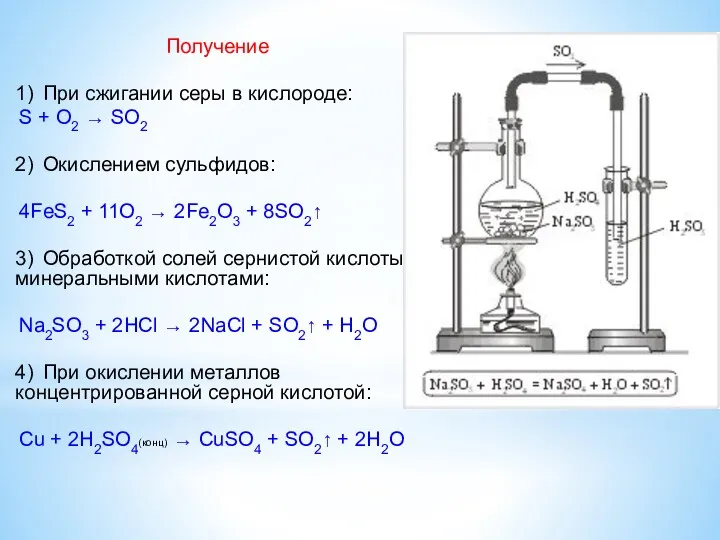
- 8. Получение 1) При сжигании серы в кислороде: S + O2 → SO2 2) Окислением сульфидов: 4FeS2
- 9. Химические свойства Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая
- 10. Оксид серы VI SO3 (серный ангидрид) Бесцветная летучая жидкость, t°пл. = 17°C; t°кип. = 66°С; на
- 11. Химические свойства 1) Серный ангидрид - кислотный оксид. При растворении в воде дает сильную двухосновную серную
- 12. СЕРНАЯ КИСЛОТА H2SO4 Тяжелая маслянистая жидкость ("купоросное масло"); ρ = 1,84 г/см3; нелетучая, хорошо растворима в
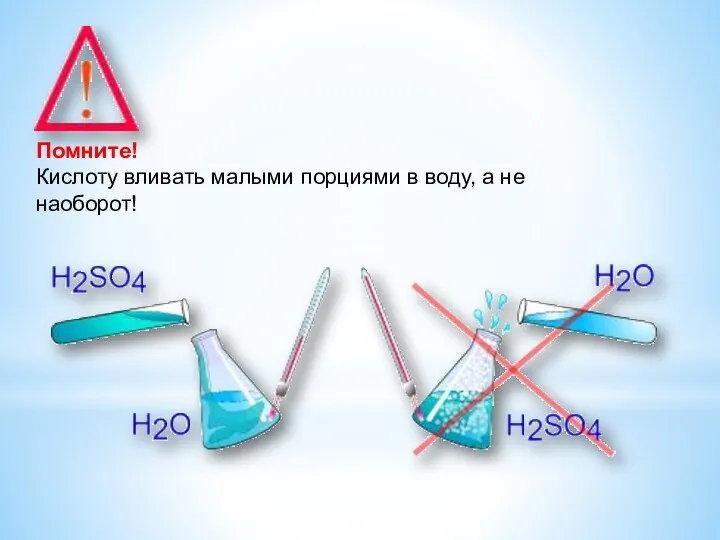
- 13. Помните! Кислоту вливать малыми порциями в воду, а не наоборот!
- 14. Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 ↔ H+ + HSO4- ↔ 2H+ + SO42-
- 16. Скачать презентацию










 Организация работы с детьми группы риска
Организация работы с детьми группы риска Архитектурное проектирование. Реконструкция городской среды с разработкой градостроительного узла
Архитектурное проектирование. Реконструкция городской среды с разработкой градостроительного узла Числа - великаны
Числа - великаны Нейропсихологические синдромы поражения конвекситальной коры височной области мозга
Нейропсихологические синдромы поражения конвекситальной коры височной области мозга ООценка кинических рекомендаций по невропатии лицевого нерва 2013 года с использованием инструмента agree. Область применения
ООценка кинических рекомендаций по невропатии лицевого нерва 2013 года с использованием инструмента agree. Область применения Специфика разработки стратегии предприятия
Специфика разработки стратегии предприятия Використання інноваційних технологій в роботі учнівського самоврядування
Використання інноваційних технологій в роботі учнівського самоврядування Индия после Второй мировой войны
Индия после Второй мировой войны Тепловые эффекты химических реакций. Энтальпия. Термохимические уравнения
Тепловые эффекты химических реакций. Энтальпия. Термохимические уравнения Современная поэзия 1998-2017
Современная поэзия 1998-2017 Единый кл час
Единый кл час Расчёт загрузки и составление грузового плана судна с проработкой маршрута перехода судна по навигационным картам и пособиям
Расчёт загрузки и составление грузового плана судна с проработкой маршрута перехода судна по навигационным картам и пособиям Опухоли яичников (часть 1)
Опухоли яичников (часть 1) Создание сайта для проведения урока информатики
Создание сайта для проведения урока информатики Правление Владимира Мономаха
Правление Владимира Мономаха А. Блок. Ветхая избушка. Сны. Ворона
А. Блок. Ветхая избушка. Сны. Ворона Полевые транзисторы JFET. (Лекция 8)
Полевые транзисторы JFET. (Лекция 8) Российские актеры
Российские актеры GTI Art 1
GTI Art 1 Микроволновая печь
Микроволновая печь Образовательное пространство в соответствии с ФГОС.
Образовательное пространство в соответствии с ФГОС. презентация на тему: Совершенствование системы физкультурно-оздоровительной работы...
презентация на тему: Совершенствование системы физкультурно-оздоровительной работы... Презентация Путешествие в прошлое деревни Кокшамары часть 3
Презентация Путешествие в прошлое деревни Кокшамары часть 3 Мышление и воображение человека
Мышление и воображение человека Презентация методического объединения педагогов Формы привлечения обучающихся в детские объединения
Презентация методического объединения педагогов Формы привлечения обучающихся в детские объединения Как не стать жертвой наркомании
Как не стать жертвой наркомании Площадь прямоугольного треугольника
Площадь прямоугольного треугольника Интегральные утройства. Элементная база РЭС. Основные функции и конструктивно-технологические параметры
Интегральные утройства. Элементная база РЭС. Основные функции и конструктивно-технологические параметры