Содержание
- 2. Термодинамика – это наука о взаимных превращениях различных видов энергии. Термохимия - раздел химической термодинамики, изучает
- 3. Химическая термодинамика изучает: переходы химической энергии в другие формы- тепловую, электрическую и. т.д. энергетические эффекты, сопровождающие
- 4. Объектом изучения в термодинамике является система. Система – тело или группа тел, отделенных от окружающей среды
- 5. Внутренняя энергия системы Внутренняя энергия системы (U) – общий запас энергии системы, который складывается из кинетической
- 6. Первый закон термодинамики (закон сохранения энергии) Выражает количественное соотношение между изменением внутренней энергии, теплотой и работой:
- 7. Изохорный процесс При химических реакциях А – это работа против внешнего давления: А = pΔV, где
- 8. Изобарный процесс (p-const) теплота Qp = ΔU + pΔV, Qp = (U2 – U1) + p(V2
- 9. Энтальпия Энтальпия ∆Н (от греческого «enthalpo» нагреваю). Эту величину иногда называют теплотой реакции. ΔH >0 реакция
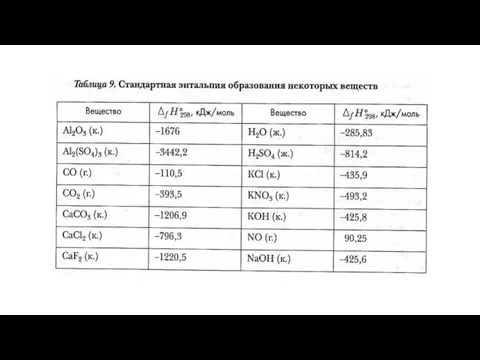
- 10. Стандартная энтальпия образования Стандартные условия: Т=298 К (250С) Р=101,3 КПа, 1 атм., 760 мм. рт. ст.
- 11. Стандартная энтальпия (теплота) образования ∆Н0298 – количество теплоты, которое выделяется (Q=-∆H) или поглощается (Q=+∆H) при образовании
- 12. Единицы измерения Значения стандартных энтальпий образования приведены в таблицах, необходимо обращать внимание на агрегатные состояния веществ.
- 14. Термохимические уравнения - это уравнения химических реакций в которых указан тепловой эффект химической реакции и агрегатные
- 15. Виды агрегатного состояния вещества
- 16. Особенности термохимических уравнений В термохимических уравнениях могут быть дробные стехиометрические коэффициенты.
- 18. Скачать презентацию














 Адаптированная программа дошкольного образования для детей с задержкой психического развития
Адаптированная программа дошкольного образования для детей с задержкой психического развития Материалы к Празднику знаний -1сентября Диск
Материалы к Празднику знаний -1сентября Диск Внеклассное мероприятие Вежливые слова
Внеклассное мероприятие Вежливые слова Своя игра (игра-соревнование)
Своя игра (игра-соревнование) Мировая экономика
Мировая экономика Азбука безопасности. Словарик
Азбука безопасности. Словарик هوش مصنوعی
هوش مصنوعی 20231026_osobennosti_organizatsii_olimpiad_po_informatike
20231026_osobennosti_organizatsii_olimpiad_po_informatike Презентация к практическому занятию по химии в 5 классе.
Презентация к практическому занятию по химии в 5 классе. D элементтеріне жалпы сипаттама
D элементтеріне жалпы сипаттама Разработка системы автоматического регулирования питания барабанного котельного агрегата водой (на материалах АО ССГПО)
Разработка системы автоматического регулирования питания барабанного котельного агрегата водой (на материалах АО ССГПО) Русь в правление Ивана Грозного (1533 - 1584)
Русь в правление Ивана Грозного (1533 - 1584) Медико-демографические проблемы населения России
Медико-демографические проблемы населения России Мультибрендовая платформа FROZA. Автозапчасти и аксессуары для авто, мото, грузовой и спецтехники
Мультибрендовая платформа FROZA. Автозапчасти и аксессуары для авто, мото, грузовой и спецтехники Modern construction technologies
Modern construction technologies Новая система обращения с твердыми коммунальными отходами
Новая система обращения с твердыми коммунальными отходами Социальная сеть Facebook
Социальная сеть Facebook Интеллектуальная игра Пентагон
Интеллектуальная игра Пентагон Загадки про грибы
Загадки про грибы Понятие и сущность международного права. (Лекция 1)
Понятие и сущность международного права. (Лекция 1) Подготовка деталей перед сборкой и сваркой. Сборка и сварка
Подготовка деталей перед сборкой и сваркой. Сборка и сварка Великобритания во второй половине XX века
Великобритания во второй половине XX века презентация №Фенол
презентация №Фенол Индекс экономической безопасности
Индекс экономической безопасности Балалардағы экг ерекшеліктері.Жүрек тондарының пайда болу механизмдері
Балалардағы экг ерекшеліктері.Жүрек тондарының пайда болу механизмдері Определение надежности, безотказности, работоспособности, долговечности, ремонтопригодности
Определение надежности, безотказности, работоспособности, долговечности, ремонтопригодности Семья.Семейные ценности.
Семья.Семейные ценности. Возбудитель коклюша Bordetella pertussis
Возбудитель коклюша Bordetella pertussis