Содержание
- 2. * Что узнаем… Положение щелочных металлов в Периодической системе Изменение свойств в группе История названия Нахождение
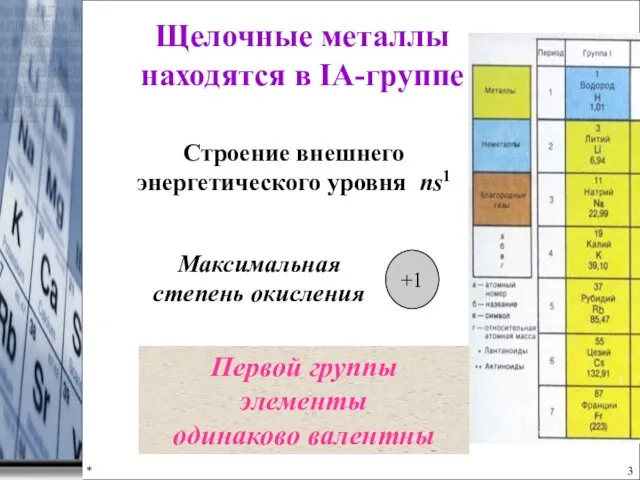
- 3. * Щелочные металлы находятся в IA-группе Максимальная степень окисления +1 Строение внешнего энергетического уровня ns1 Первой
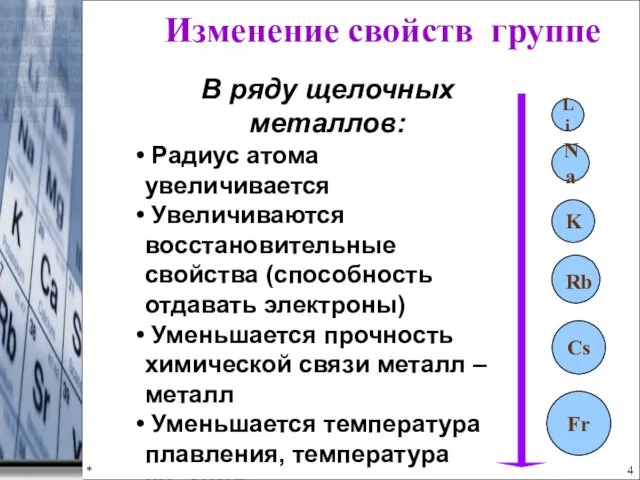
- 4. * Fr K Na Li Изменение свойств группе В ряду щелочных металлов: Радиус атома увеличивается Увеличиваются
- 5. * «Если не знать имен - умрет и познание вещей» Карл Линней
- 6. * ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Литий был открыт шведским химиком Й. Арведсоном в 1817 г. по предложению
- 7. * Нахождение в природе Натрий и калий широко распространены в природе в виде солей Соединения других
- 8. * Кислородные соединения щелочных металлов
- 9. * Щелочные металлы легкоплавки и мягки, серебристы, как снежки… Металлический цезий в ампуле Физические свойства Металлический
- 10. * Эти металлы получили название щелочных, потому что большинство их соединений растворимы в воде. По-славянски «выщелачивать»
- 11. * Химические свойства Щелочные металлы активно взаимодействуют почти со всеми неметаллами: 2Ме0 + Н20 = 2Ме+1Н-1
- 12. * Химические свойства Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина Все щелочные металлы активно
- 13. * Окраска пламени ионами щелочных металлов Li+ K+ Na+ Cs+
- 14. * Закрепление С помощью уравнений реакций осуществите превращения: 1) Na → Na2O2 → Na2O NaOH →
- 15. * Домашнее задание § 11, упр. 4, 5
- 17. Скачать презентацию












 Милосердие, забота о слабых, взаимопомощь ОРКСЭ
Милосердие, забота о слабых, взаимопомощь ОРКСЭ Сегментирование международных рынков
Сегментирование международных рынков Лапаротомии. Виды лапаротомий
Лапаротомии. Виды лапаротомий Диагностика вирусных гепатитов
Диагностика вирусных гепатитов Лечебная физкультура при белково-энергетической недостаточности
Лечебная физкультура при белково-энергетической недостаточности Мұз бен тығыздалған қарды жоюға арналған машиналар
Мұз бен тығыздалған қарды жоюға арналған машиналар Каталог текстильных тканей
Каталог текстильных тканей Роль песочной терапии в развитии эмоциональной сферы детей дошкольного возраста
Роль песочной терапии в развитии эмоциональной сферы детей дошкольного возраста Основы научно-исследовательской работы в школе. Выпускная квалификационная работа
Основы научно-исследовательской работы в школе. Выпускная квалификационная работа День Матери
День Матери Бас ми жарақаттары
Бас ми жарақаттары Обобщение опыта работы по теме Использование ИКТ в начальной школе.
Обобщение опыта работы по теме Использование ИКТ в начальной школе. Права и обязанности детей
Права и обязанности детей Техническое задание. Пожелания по разработке дизайна сайта
Техническое задание. Пожелания по разработке дизайна сайта Час земли
Час земли Металдар мен қорытпаларды құю және Шөміш
Металдар мен қорытпаларды құю және Шөміш ВИЧ-инфекция
ВИЧ-инфекция Загадочный мир. Зима
Загадочный мир. Зима Основы экономики. Деньги
Основы экономики. Деньги Развитие психики в филогенезе. Инстинктивные и индивидуально приобретаемые формы поведения
Развитие психики в филогенезе. Инстинктивные и индивидуально приобретаемые формы поведения Викторина-игра по правилам дорожного движения
Викторина-игра по правилам дорожного движения Экономика и экология
Экономика и экология Природа России
Природа России Православное вероучение – основные положения Православной Церкви
Православное вероучение – основные положения Православной Церкви презентация Основы электротехники
презентация Основы электротехники Конкурс Я живу в Красноярском крае. Виртуальная викторина
Конкурс Я живу в Красноярском крае. Виртуальная викторина Материалы по ОДОД
Материалы по ОДОД Верховино 1917-1920
Верховино 1917-1920