Слайд 2

Происхождение названий
щелочных металлов
Li (1817) лат. " литос" - камень
Na (1807)
араб. "натрум" -сода
К (1807) араб. "алкали" - щелочь
Rb (1861) лат. "рубидус" - темно-красный
Cs (1860) лат. "цезиус" - небесно-голубой
Fr (1939) от названия страны Франция.
Слайд 3

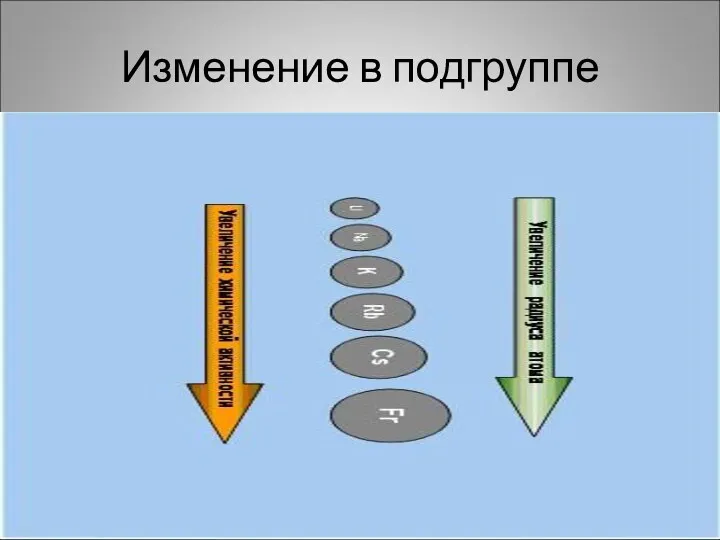
Положение в периодической системе химических элементов Д.И.Менделеева
I группа главная подгруппа.
Увеличивается
радиус атомов ,
растет восстановительная способность
Слайд 4
Слайд 5

Слайд 6
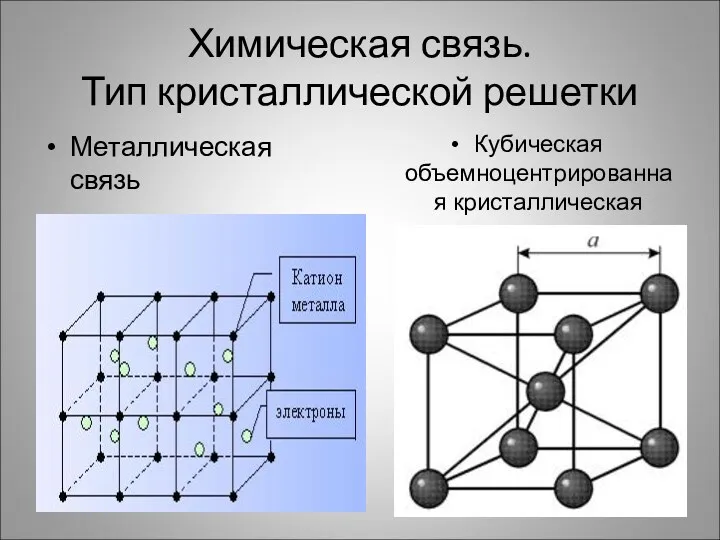
Химическая связь.
Тип кристаллической решетки
Металлическая связь
Кубическая объемноцентрированная кристаллическая решетка
Слайд 7

Слайд 8
Слайд 9

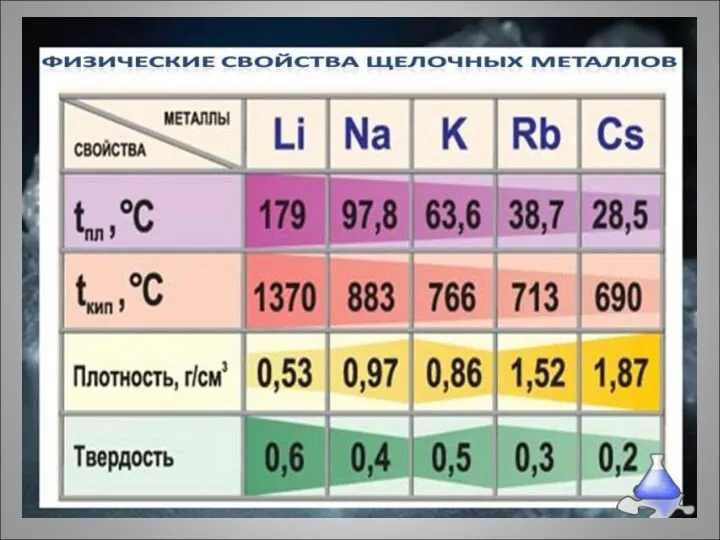
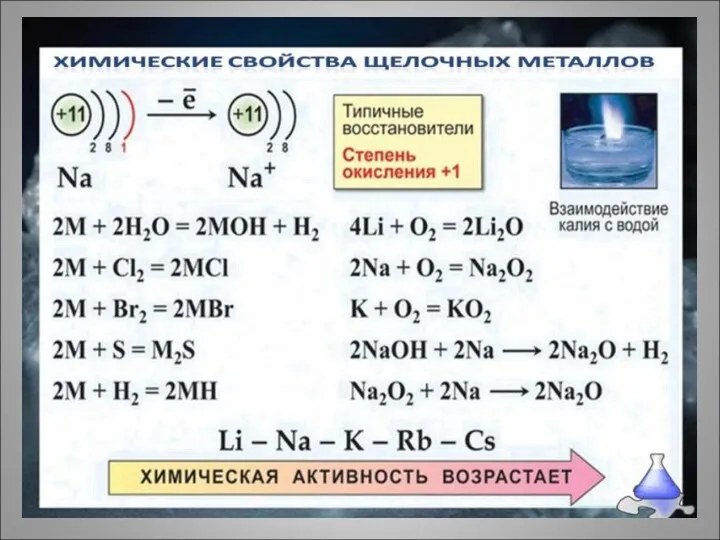
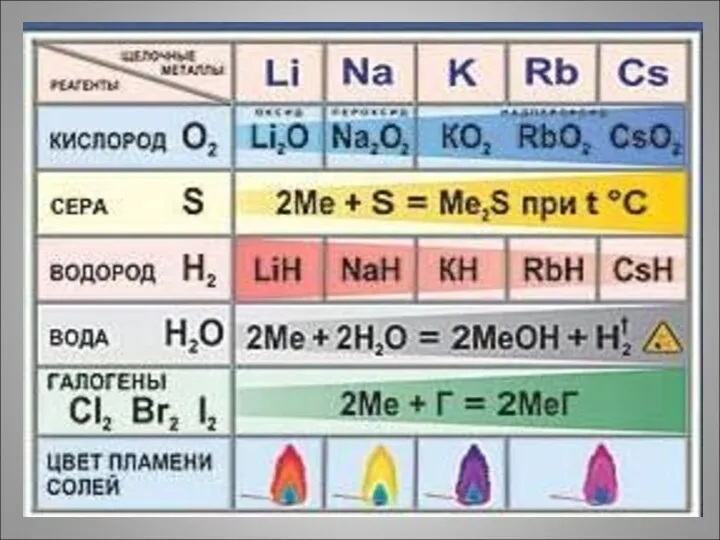
Химические свойства
щелочных металлов
Типичные металлы, очень сильные восстановители. В соединениях проявляют
единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Взаимодействуют с водой воде с образованием гидроксидов (R–OH)– щёлочей.
Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды (кроме лития).
Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs
Слайд 10
Слайд 11
Слайд 12

Окрашивание пламени солями натрия и калия
Слайд 13

Получение
Так как щелочные металлы - это самые сильные восстановители, их можно
восстановить из соединений только при электролизе расплавов солей
2NaCl=2Na+Cl2
Слайд 14

Вопросы:
Обратите внимание на соединения, образующиеся при химическом взаимодействии щелочных металлов с
кислородом. Сравните полученные вещества.
Что представляют собой гидриды щелочных металлов?
Что образуется при взаимодействии щелочных металлов с водой? Сравните скорость реакций.
Какие вещества образуются при взаимодействии щелочных металлов с галогенами?
Как распознать соединения щелочных металлов (обратите внимание на цвет пламени)?
Слайд 15

Проверка выполненных заданий:
2М + 2H2O → 2МOH + H2 (щелочь и
водород)
2М + Cl2 → 2МCl (галогениды)
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (надпероксид калия)
2М + Н2 → 2МH (гидриды)
6М + N2 → 2М3N (нитриды)
Слайд 16

Электронный баланс для взаимодействия щелочных металлов с водой
M0 –
1 ē → M+ 2-восстановитель
2
2Н+ + 2 ē → Н20 1-окислитель
Слайд 17

сегодня на уроке…
было интересно… было трудно… я выполнял задания… я
понял, что… теперь я могу… я почувствовал, что… я научился… я приобрел… у меня получилось … я смог… я попробую… меня удивило… урок дал мне для жизни… мне захотелось…
















 Самоиндукция. Индуктивность
Самоиндукция. Индуктивность Частотно – регулируемый асинхронный электропривод
Частотно – регулируемый асинхронный электропривод Правотворчество и формирование закона
Правотворчество и формирование закона Деревянные балки в покрытиях и перекрытиях
Деревянные балки в покрытиях и перекрытиях Сердечнолегочная реанимация у детей
Сердечнолегочная реанимация у детей Конкурентные преимущества Raw Life Protein
Конкурентные преимущества Raw Life Protein Роль родного языка и речи в развитии ребенка
Роль родного языка и речи в развитии ребенка НУЗ Дорожная клиническая больница ОАО РЖД. Преимущества на рынке медицинских услуг
НУЗ Дорожная клиническая больница ОАО РЖД. Преимущества на рынке медицинских услуг Организация контроля на уроках информатики
Организация контроля на уроках информатики Approaches. Discussion
Approaches. Discussion Таблица умножения и деления на 2
Таблица умножения и деления на 2 Импульс тела. Закон сохранения импульса. Реактивное движение
Импульс тела. Закон сохранения импульса. Реактивное движение Право на образование
Право на образование Старая Уфа
Старая Уфа Доказательная медицина. Формулярная система. Фармакоэпидемиология
Доказательная медицина. Формулярная система. Фармакоэпидемиология Казань - спортивная столица
Казань - спортивная столица Социальное партнёрство с родителями, как условие развития творческих способностей обучающихся
Социальное партнёрство с родителями, как условие развития творческих способностей обучающихся  Разработка GIF-анимации через Photoshop
Разработка GIF-анимации через Photoshop Основні симптоми та синдроми при цукровому діабеті
Основні симптоми та синдроми при цукровому діабеті Неопределенные местоимения
Неопределенные местоимения Системы двух линейных уравнений с двумя переменными, как математические модели реальных ситуаций. 7 класс
Системы двух линейных уравнений с двумя переменными, как математические модели реальных ситуаций. 7 класс Колядки
Колядки Грыжи. Классификация грыж
Грыжи. Классификация грыж Методы исследования механической активности сердца
Методы исследования механической активности сердца Производство облицовочных работ
Производство облицовочных работ Ресторан BigMama
Ресторан BigMama Психические и поведенческие расстройства в результате употребления летучих растворителей (ингалянтов)
Психические и поведенческие расстройства в результате употребления летучих растворителей (ингалянтов) Презентация проекта Волшебная пуговица.
Презентация проекта Волшебная пуговица.