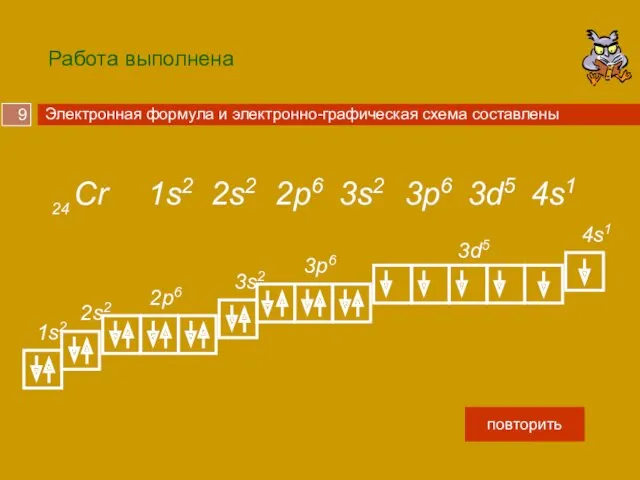
У хрома 24 электрона , запишем это число на черновике.
Первым в атоме заполняется
1s подуровень
На нем максимально может быть 2 электрона, отметим их и вычтем из 24.
Осталось разместить 22 электрона. Заполняется следующий 2s подуровень, на нем может быть 2 электрона. Проделаем аналогичные операции.
Дошли до 3d подуровня, на нем максимально может быть 10 электронов, но осталось только 4, их и помещаем.
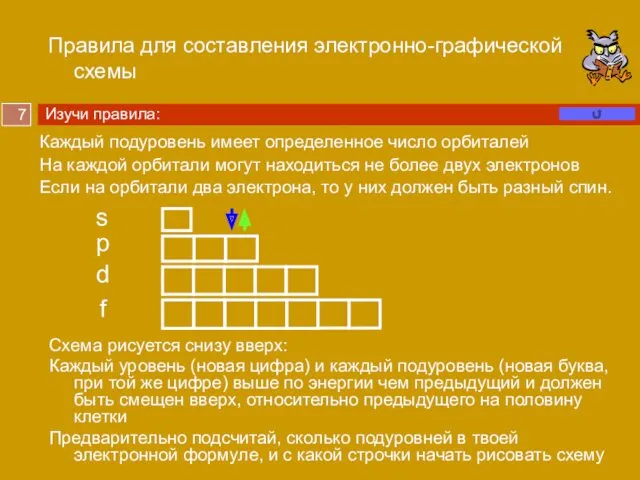
Порядок заполнения энергетических уровней в атоме.
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4р6 …
1s
2. По образцу составь электронную формулу.
Эту часть выполнили идем дальше
22
24
- 2 =
Cr
24
2
2
2
2
6
6
3s
2s
4s
2p
3p
3d
- 2 =
- 6 =
- 2 =
- 6 =
- 2 =
20
14
12
6
4






 Программы для занятий
Программы для занятий Организация сравнительных сценариев ТВ Samsung In-store
Организация сравнительных сценариев ТВ Samsung In-store Презентация к занятию на тему: Форма, цвет, размер
Презентация к занятию на тему: Форма, цвет, размер Основные методы и особенности оценки земель сельскохозяйственного назначения
Основные методы и особенности оценки земель сельскохозяйственного назначения Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов
Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов История возникновения степени числа (7 класс)
История возникновения степени числа (7 класс) Электронные образовательные ресурсы в начальной школе
Электронные образовательные ресурсы в начальной школе Түйсік және ес
Түйсік және ес Культурные растения
Культурные растения Моё село.
Моё село. Древнегреческий скульптор Поликлет
Древнегреческий скульптор Поликлет Устал от своей работы?
Устал от своей работы? Атмосферный воздух и его физические свойства. (Лекция 5)
Атмосферный воздух и его физические свойства. (Лекция 5) Презентация Открытка к 8 марта
Презентация Открытка к 8 марта Образование и культура в XVII веке в России
Образование и культура в XVII веке в России Смысл жертвы Иисуса Христа
Смысл жертвы Иисуса Христа Переработка алюмо-силикатной микросферы
Переработка алюмо-силикатной микросферы Предметно - развивающая среда логопедического кабинета и группы детского сада
Предметно - развивающая среда логопедического кабинета и группы детского сада Народные росписи
Народные росписи Хранение варено-копченых колбас
Хранение варено-копченых колбас Божа благодать в житті християнина
Божа благодать в житті християнина Әртүрлі құрылыс материалдарының беріктігі мен жылуөткізгіштігін зерттеу
Әртүрлі құрылыс материалдарының беріктігі мен жылуөткізгіштігін зерттеу Невропатология. Данные о патологии нервной системы
Невропатология. Данные о патологии нервной системы Великой Победе посвящается....
Великой Победе посвящается.... Родительское собрание. Возрастные особенности учащихся 2-х классов.
Родительское собрание. Возрастные особенности учащихся 2-х классов. Тест по рассказу В.М. Шукшина Срезал
Тест по рассказу В.М. Шукшина Срезал Технология гибридных микросхем
Технология гибридных микросхем Права ребенка
Права ребенка