Содержание
- 2. Содержание
- 3. СПИРТЫ CxHy (OH)n Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько гидроксильных групп, связанных
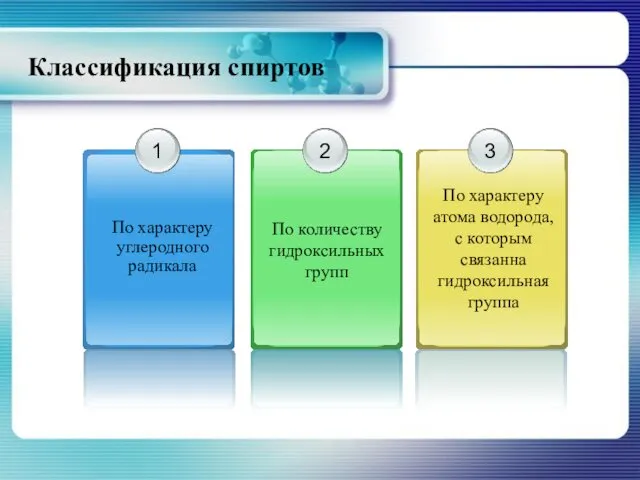
- 4. Классификация спиртов
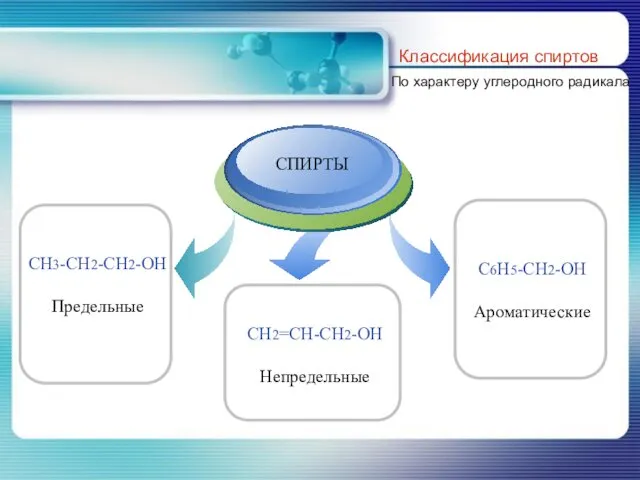
- 5. Классификация спиртов По характеру углеродного радикала
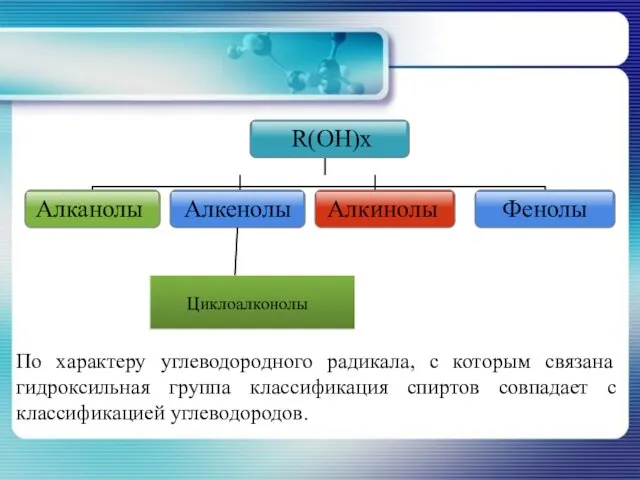
- 6. По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.
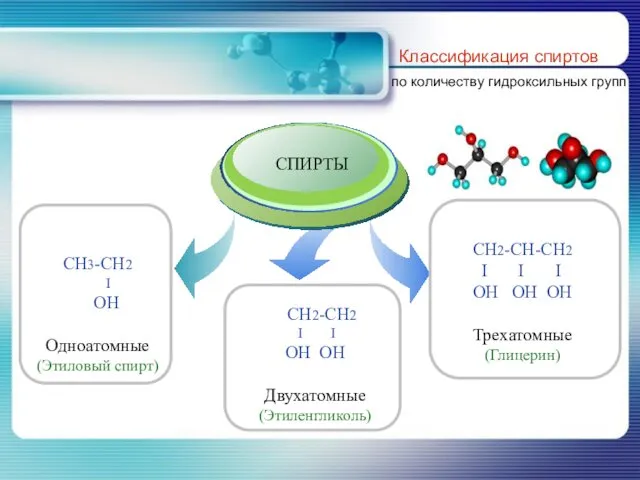
- 7. Классификация спиртов по количеству гидроксильных групп
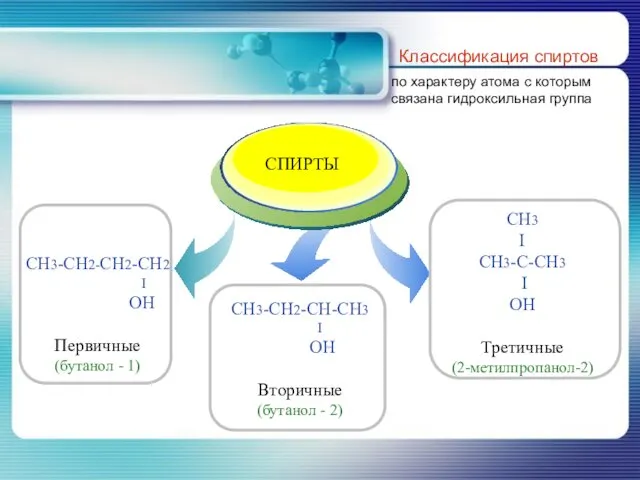
- 8. Классификация спиртов по характеру атома с которым связана гидроксильная группа
- 9. Алканолы образуют гомологический ряд общей формулы CnH2n+1OH (n=1,2,3,:N). Названия алканолов по систематичес-кой номенклатуре строятся из названий
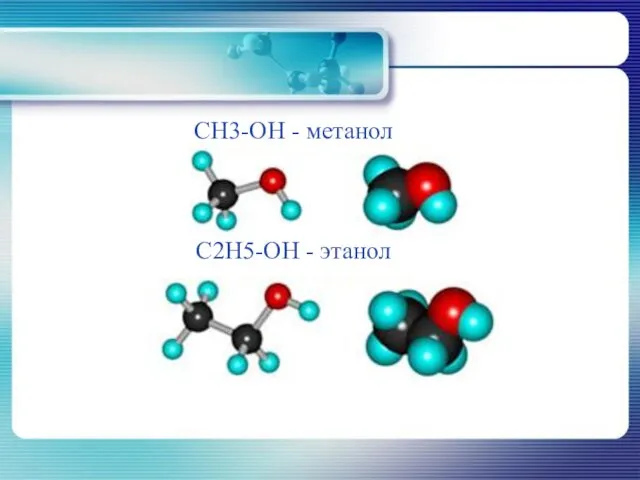
- 10. CH3-OH - метанол C2H5-OH - этанол
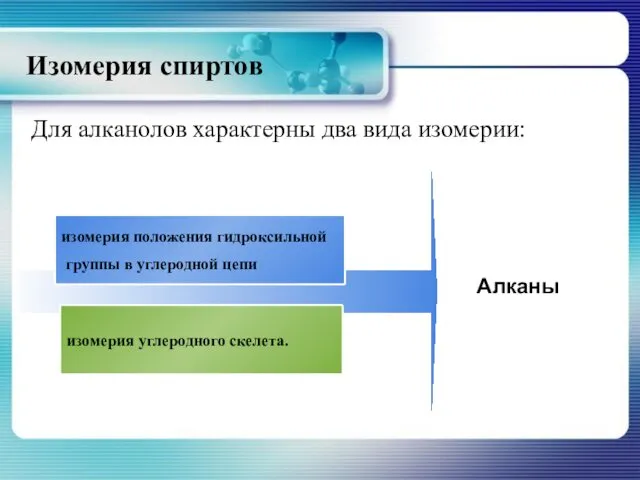
- 11. Изомерия спиртов Для алканолов характерны два вида изомерии:
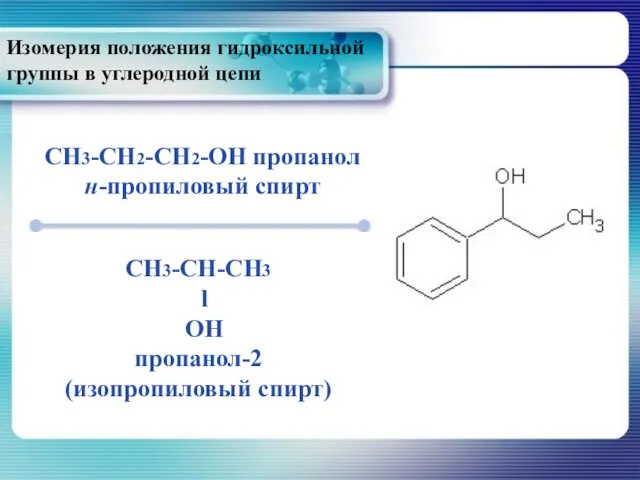
- 12. Изомерия положения гидроксильной группы в углеродной цепи CH3-CH2-CH2-OH пропанол н-пропиловый спирт CH3-CH-CH3 l OH пропанол-2 (изопропиловый
- 13. CH3-CH2-CH2-CH2-OH бутанол-1 (н-бутиловый спирт) CH3-CH-CH2-OH l CH3 2-метилпропанол-1 (изобутиловый спирт) Первым из спиртов, для которого характерны
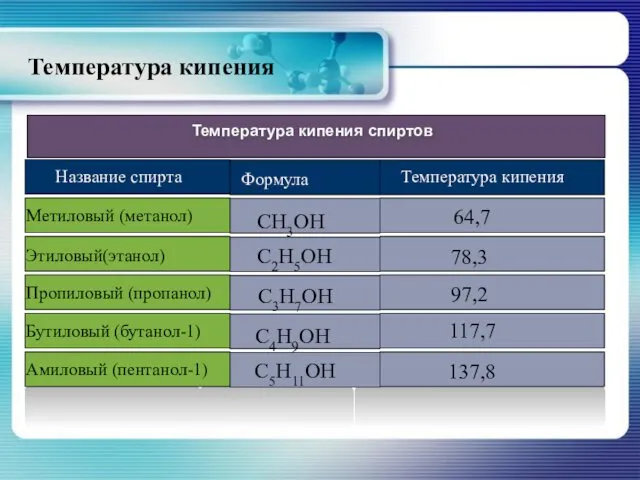
- 14. Физические свойства спиртов Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического
- 15. Температура кипения
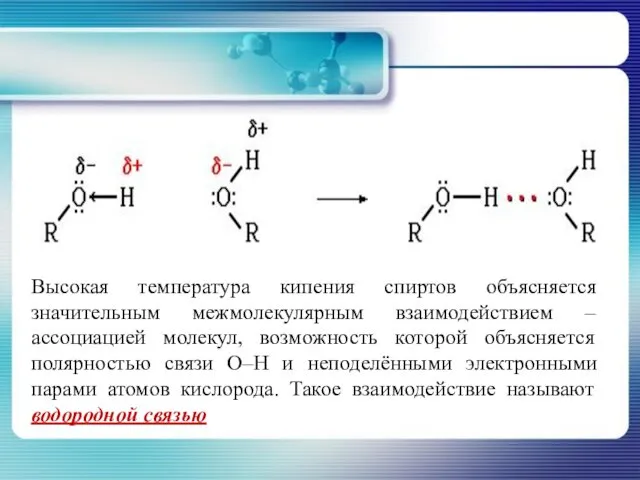
- 16. Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул, возможность которой объясняется полярностью связи
- 17. Строение молекулы этанола В молекуле этанола атомы углерода, водорода и кислорода связаны только одинарными - связями.
- 18. Химические свойства спиртов Реакционная способность спиртов обусловлена наличием в их молекулах полярных связей, способных разрываться по
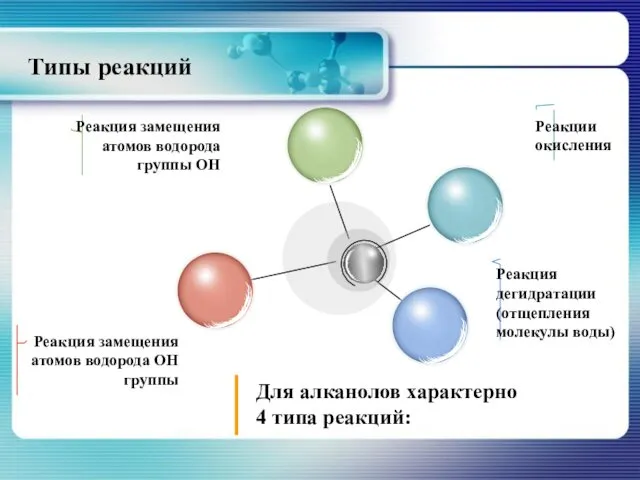
- 19. Типы реакций
- 20. Реакция замещения водорода -ОН группы 2С2Н5ОН + 2Na →2 C2H5ONa + H2 C2H5ONa + H2O →
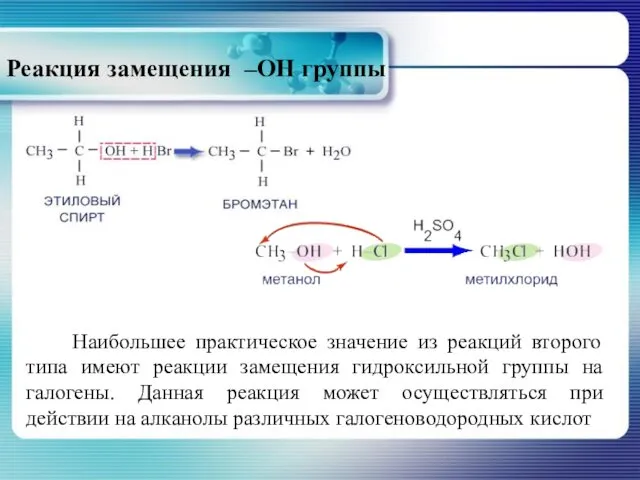
- 21. Реакция замещения –ОН группы Наибольшее практическое значение из реакций второго типа имеют реакции замещения гидроксильной группы
- 22. Реакция дегидратации Для алканолов характерно два типа реакции дегидратации: - внутримолекулярная и - межмолекулярная При внутримолекулярной
- 23. Внутримолекулярная дегидратация Внутримолекулярная дегидратация алканолов может осуществляться при нагревании их с избытком концентрированной H2SO4 при t
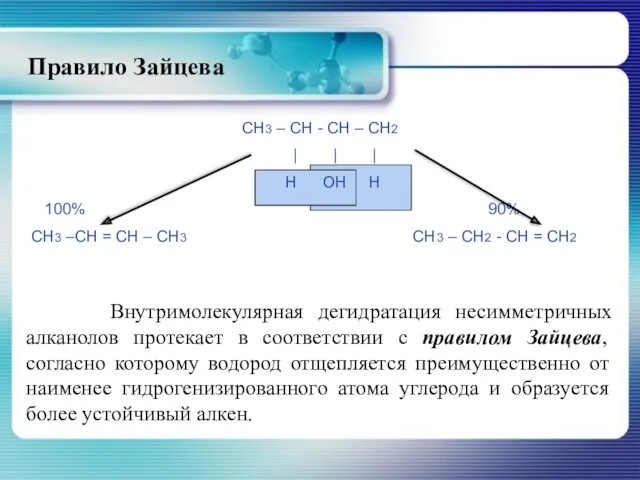
- 24. Правило Зайцева Внутримолекулярная дегидратация несимметричных алканолов протекает в соответствии с правилом Зайцева, согласно которому водород отщепляется
- 25. Межмолекулярная дегидротация При более слабом нагревании этилового спирта с серной кислотой образуется диэтиловый эфир. Это летучая,
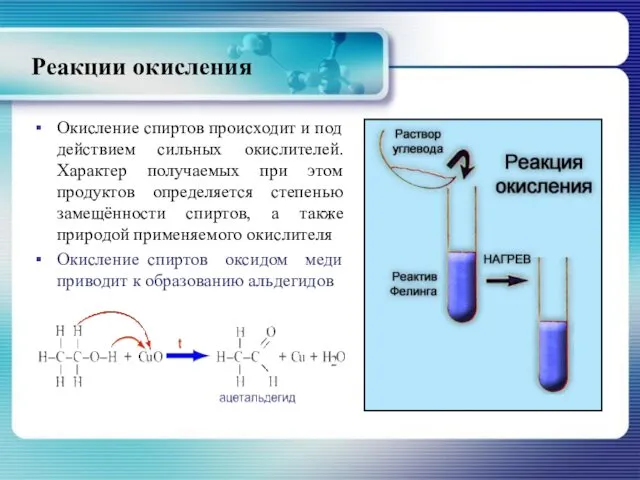
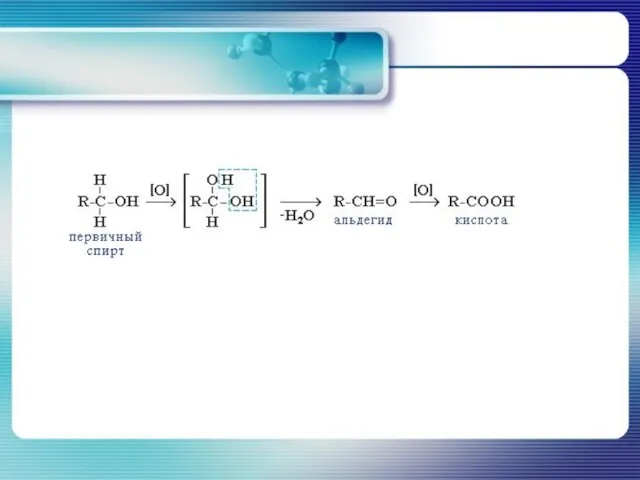
- 26. Реакции окисления Окисление спиртов происходит и под действием сильных окислителей. Характер получаемых при этом продуктов определяется
- 29. Метанол и этанол Метанол получают гидрированием оксида углерода (II) СО. В настоящее время разработан способ получения
- 30. Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
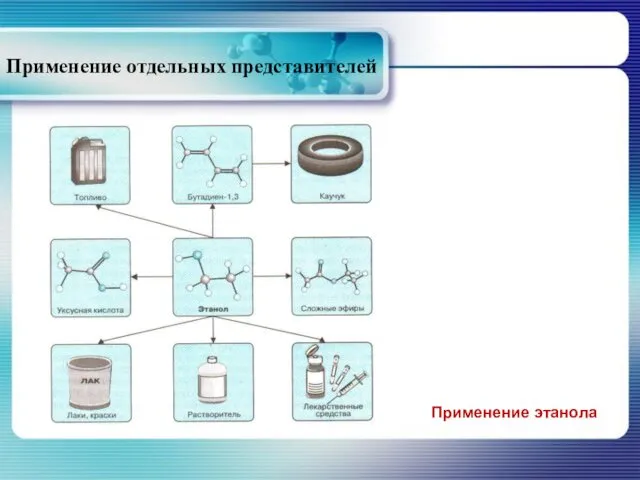
- 31. Применение отдельных представителей Применение этанола
- 32. Мировое производство мета-нола составляет около 10 мил-лионов тонн в год, этанола производится примерно на порядок больше.
- 33. Контрольные задания 1. Задача. Вывести молекулярную формулу вещества, если оно содержит С (ω=39,97%), Н (ω=6,73%) и
- 35. Скачать презентацию















 Работа с программно-аппаратным комплексом УКЭБ производства компании Электронный вокзал
Работа с программно-аппаратным комплексом УКЭБ производства компании Электронный вокзал Питание и кормление пациентов
Питание и кормление пациентов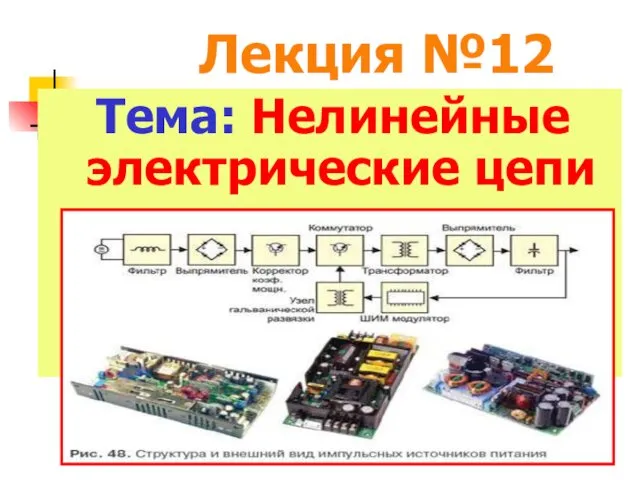 Нелинейные электрические цепи
Нелинейные электрические цепи У Васюньки день народження
У Васюньки день народження Беспроводные локальные сети Wlan
Беспроводные локальные сети Wlan Нефть и её транспортировка
Нефть и её транспортировка Ettevõtete ühinemised ja ülevõtmised Tulemuslikkuse hindamise süsteemid
Ettevõtete ühinemised ja ülevõtmised Tulemuslikkuse hindamise süsteemid Проектная работа. Здоровье. Правильная осанка- залог здоровья
Проектная работа. Здоровье. Правильная осанка- залог здоровья Кроссворд по правилам дорожного движения
Кроссворд по правилам дорожного движения Исследовательская работа Участники ВОВ - наши земляки
Исследовательская работа Участники ВОВ - наши земляки звуковой анализ
звуковой анализ Объяснения сторон и третьих лиц
Объяснения сторон и третьих лиц Мастер - класс на тему:Развитие познавательных способностей у дошкольников через использование песочной терапии
Мастер - класс на тему:Развитие познавательных способностей у дошкольников через использование песочной терапии Лечебное питание при заболеваниях почек и мочевыводящих путей
Лечебное питание при заболеваниях почек и мочевыводящих путей Презентация к классному часу Всех на свете дороже доброта
Презентация к классному часу Всех на свете дороже доброта Достопримечательности города Дрезден
Достопримечательности города Дрезден Информационные технологии давно стали частью образовательного процесса, однако с появлением ЭОР открылась новая страница
Информационные технологии давно стали частью образовательного процесса, однако с появлением ЭОР открылась новая страница Общие сведения о металлах и сплавах
Общие сведения о металлах и сплавах История, которая вас удивит: что изучает историческая наука и как писать историю
История, которая вас удивит: что изучает историческая наука и как писать историю Презентация5
Презентация5 Воспалительные заболевания кишечника: неспецифический язвенный колит и болезнь Крона
Воспалительные заболевания кишечника: неспецифический язвенный колит и болезнь Крона Угрозы безопасности информации. Преднамеренные угрозы
Угрозы безопасности информации. Преднамеренные угрозы Дидактическая игра для детей 3-4 лет Найди две одинаковые машины
Дидактическая игра для детей 3-4 лет Найди две одинаковые машины Ликуй студент! Учись и здравствуй! Ко Дню Российского студенчества
Ликуй студент! Учись и здравствуй! Ко Дню Российского студенчества Конструирование одежды
Конструирование одежды Рынок банковских карт в России: проблемы и перспективы развития
Рынок банковских карт в России: проблемы и перспективы развития Архитектор Михаил Павлович Малахов (1781-1842)
Архитектор Михаил Павлович Малахов (1781-1842) Мероприятия по повышению эффективности деятельности компании и управлению затратами
Мероприятия по повышению эффективности деятельности компании и управлению затратами