Содержание
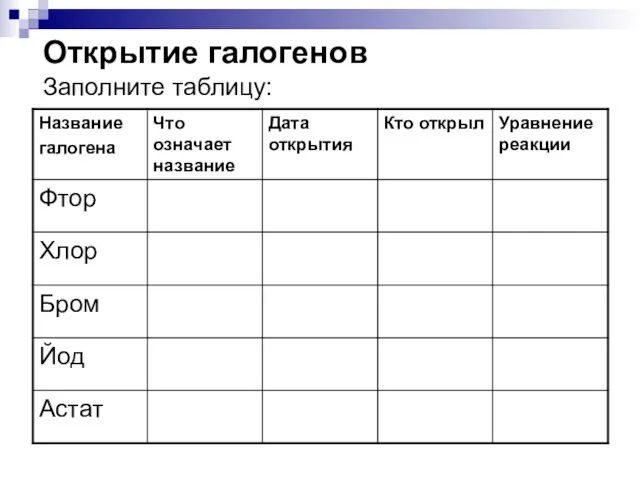
- 2. Открытие галогенов Заполните таблицу:
- 3. Открытие фтора Фтор(F2) –от греч. «фторос»- разрушающий был открыт в 1866 году французским химиком Анри Муассаном
- 4. Открытие хлора Хлор Cl2 от греч. «хлорос» - желто-зеленый 1774 год Шведский аптекарь Карл Вильгельм Шееле
- 5. Открытие брома Бром (Br2) от греч. «бромос»- зловонный Был открыт в 1826 году Французским химиком (24-летним
- 6. Открытие йода Йод (I2) от греч. «иодес» - фиолетовый Был открыт в 1811 году Французским химиком-технологом
- 7. Открытие астата Астат(At2) от греч. «астатос» - неустойчивый Был получен в 1940 году Искусственным путем при
- 8. Строение атомов галогенов F+9 ) ) 2 7 Cl+17 ) ) ) 2 8 7 Br+35
- 9. Физические свойства простых веществ-галогенов Бром Йод Хлор Астат
- 10. Возгонка йода Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое
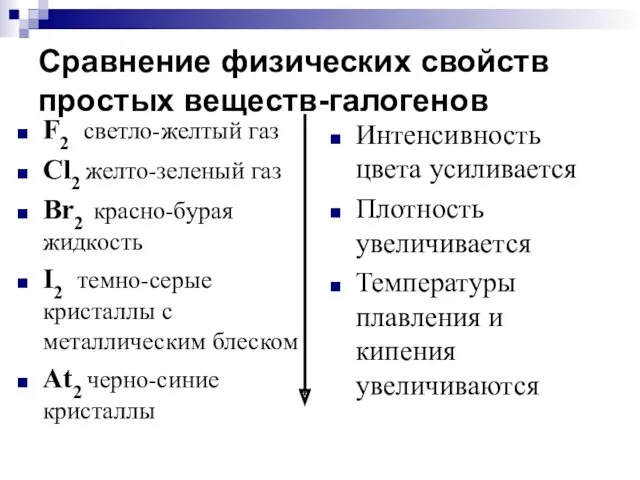
- 11. Сравнение физических свойств простых веществ-галогенов F2 светло-желтый газ Cl2 желто-зеленый газ Br2 красно-бурая жидкость I2 темно-серые
- 12. Химические свойства фтора Взаимодействует со всеми металлами с выделением большого количества теплоты: с алюминием: 3F2 +
- 13. Химические свойства фтора Реагирует при облучении даже с инертными газами Xe + F2 → Xe F2
- 14. Химические свойства брома Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока. С
- 15. Химические свойства йода Химическая активность йода еще ниже, чем у брома. С металлами только при нагревании:
- 16. Вывод: химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может
- 17. Качественные реакции на галогенид-ионы Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl
- 18. Галогены и здоровье Заполни таблицу:
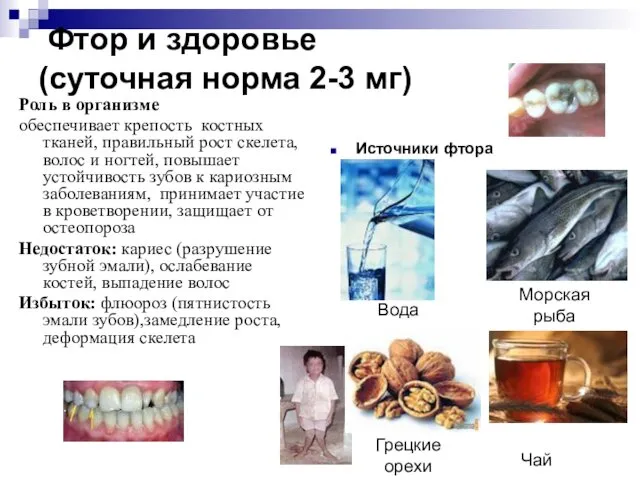
- 19. Фтор и здоровье (суточная норма 2-3 мг) Роль в организме обеспечивает крепость костных тканей, правильный рост
- 20. Хлор и здоровье (суточная норма 2г) Роль в организме: Образование соляной кислоты, поддержание водно-электролитного баланса, выведение
- 21. Бром и здоровье (суточная норма 0,5-2 мг) Роль в организме: принимает участие в регуляции деятельности нервной
- 23. Скачать презентацию

















 Портфолио воспитателя
Портфолио воспитателя Типы и этапы урока в специальном (коррекционном) классе VIII вида
Типы и этапы урока в специальном (коррекционном) классе VIII вида Культура поведения
Культура поведения Урок русского языка 02.02.2022 г
Урок русского языка 02.02.2022 г составление цветового круга
составление цветового круга приглашение
приглашение Simulation modeling of the gas-turbine aviation engine under
Simulation modeling of the gas-turbine aviation engine under великобритания Диск
великобритания Диск Наложение повязок
Наложение повязок Презентация мини-музея Русская изба с детьми старшего дошкольного возраста
Презентация мини-музея Русская изба с детьми старшего дошкольного возраста Безопасность врача-рентгенолога
Безопасность врача-рентгенолога ПЛАНЕТЫ ЗЕМНОЙ ГРУППЫ (МЕРКУРИЙ, ВЕНЕРА)
ПЛАНЕТЫ ЗЕМНОЙ ГРУППЫ (МЕРКУРИЙ, ВЕНЕРА) Презентация Воспитание культуры общения старшеклассников во внеурочное время
Презентация Воспитание культуры общения старшеклассников во внеурочное время День Науки в нашем классе.
День Науки в нашем классе. Всероссийская молодежная форумная кампания
Всероссийская молодежная форумная кампания Достопримечательности города Городец.
Достопримечательности города Городец. Основные составляющие шрифта
Основные составляющие шрифта Аномалии развития нервной системы человека
Аномалии развития нервной системы человека Informācija saimnieciskās darbības veicējiem
Informācija saimnieciskās darbības veicējiem Общие закономерности нормального и отклоняющего развития
Общие закономерности нормального и отклоняющего развития Картотека Прогулка весной
Картотека Прогулка весной Инструменты и приспособления для швейных работ. ТБ при выполнении швейных работ
Инструменты и приспособления для швейных работ. ТБ при выполнении швейных работ Реализация строительных материалов
Реализация строительных материалов Кластар. Кластың айнымалылары мен әдістерін жариялау
Кластар. Кластың айнымалылары мен әдістерін жариялау Ремесленники Древней Руси
Ремесленники Древней Руси Предупреждение и удаление отложений солей при эксплуатации скважин, оборудованных УЭЦН в условиях АЦДНГ №5 НГДУ Арланнефть
Предупреждение и удаление отложений солей при эксплуатации скважин, оборудованных УЭЦН в условиях АЦДНГ №5 НГДУ Арланнефть Уход при ангине
Уход при ангине Азия
Азия