Содержание
- 2. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле !
- 3. Демокрит В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие
- 4. М.В. Ломоносов (1711-1765 гг.) Материя состоит из мельчайших первичных частиц, или атомов. Атомы неделимы и не
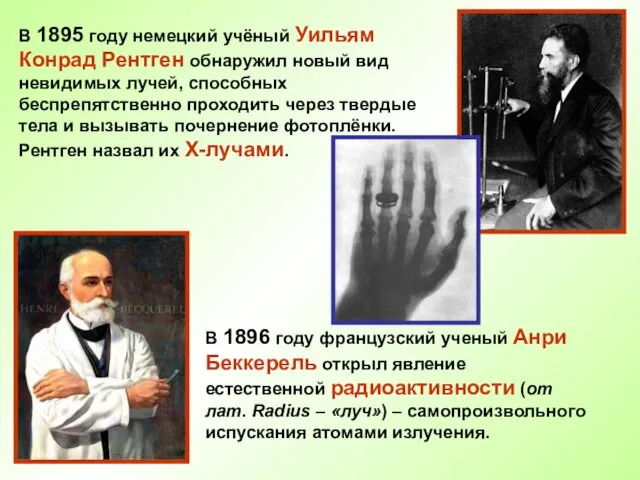
- 5. В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить
- 6. В 1898 году Пьер Кюри и Мария Склодовская – Кюри, изучавшие явление радиоактивности, открыли новые элементы
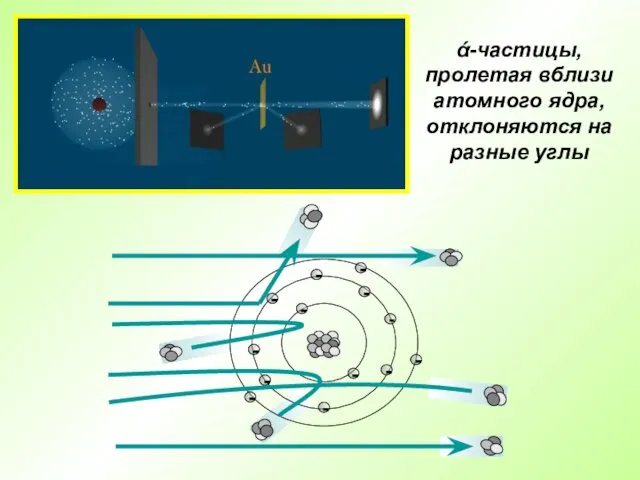
- 7. Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома Опыт Резерфорда: поток ά-частиц, излучаемый радиоактивным
- 8. ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
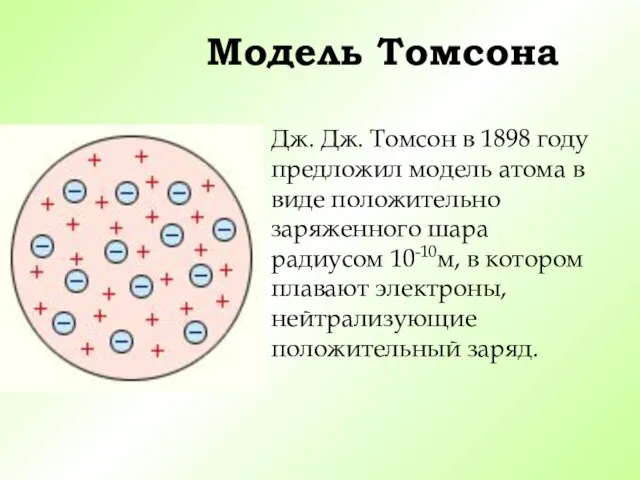
- 9. Модель Томсона Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара
- 10. Э. Резерфорд предложил планетарную модель атома: в центре находится положительно заряженное ядро, которое имеет достаточно малые
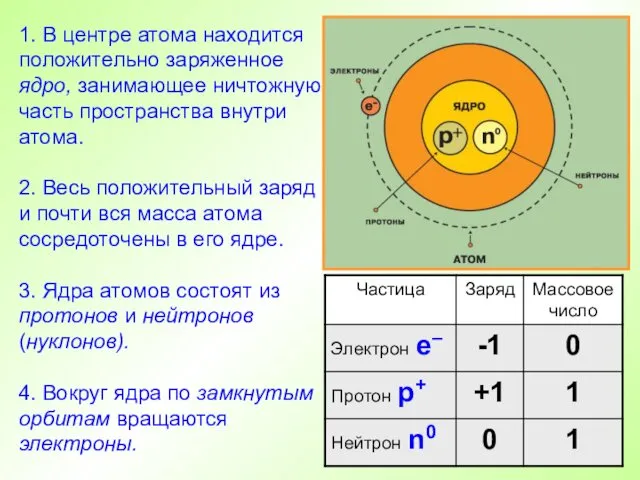
- 11. 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. 2. Весь
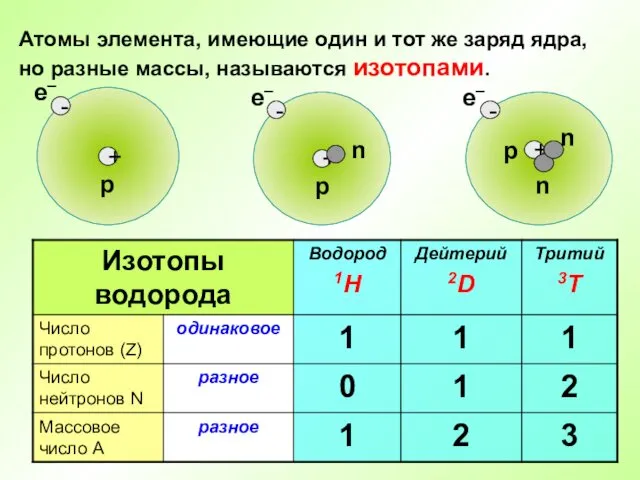
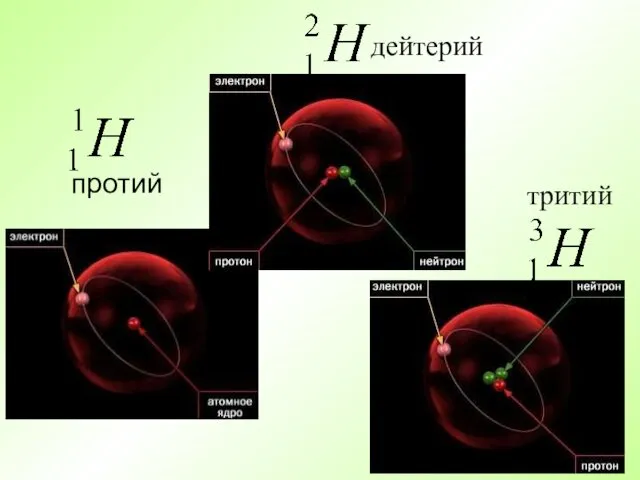
- 12. Атомы элемента, имеющие один и тот же заряд ядра, но разные массы, называются изотопами.
- 13. протий дейтерий тритий
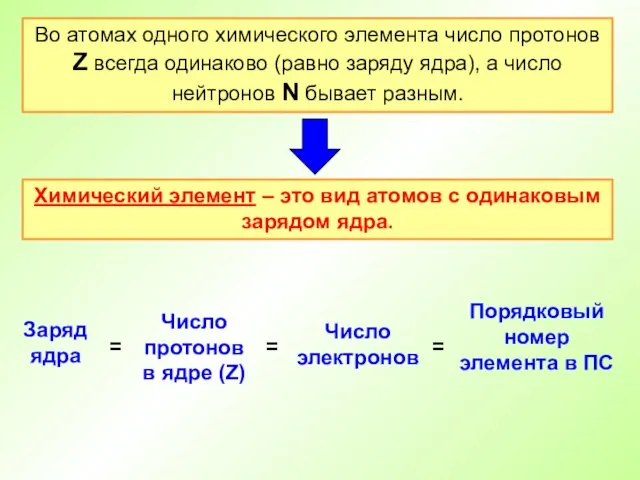
- 14. Во атомах одного химического элемента число протонов Z всегда одинаково (равно заряду ядра), а число нейтронов
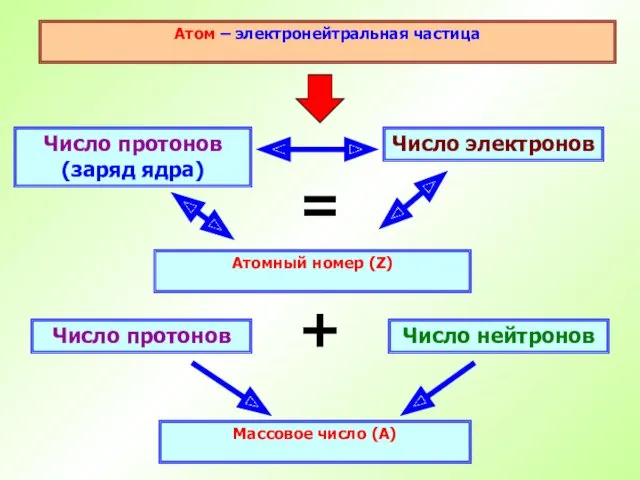
- 15. Атом – электронейтральная частица Число протонов (заряд ядра) Атомный номер (Z) Число электронов = Число нейтронов
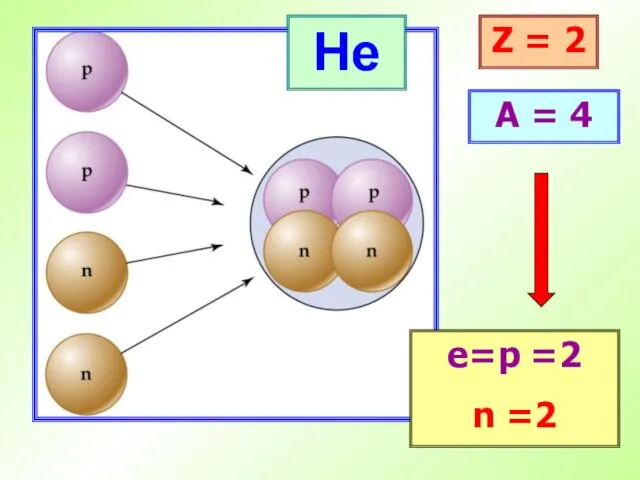
- 16. He Z = 2 A = 4 е=p =2 n =2
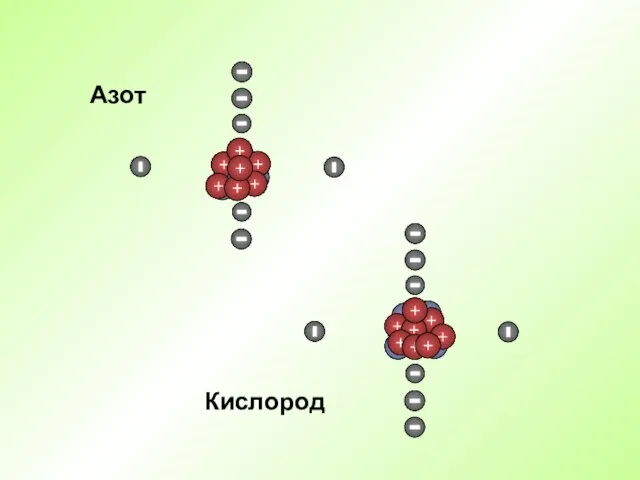
- 17. Кислород Азот
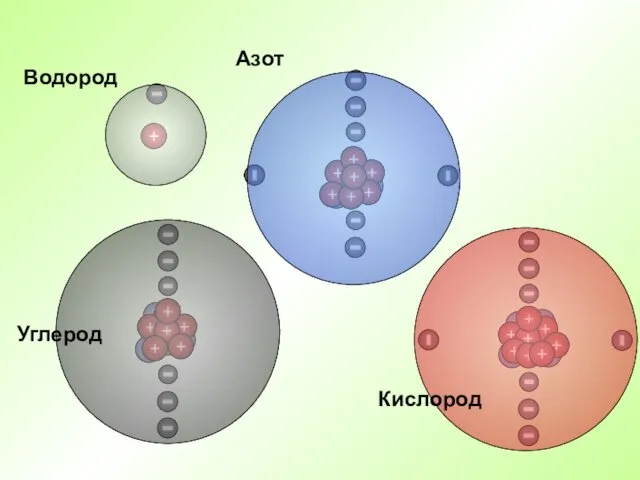
- 18. Водород Азот Кислород Углерод
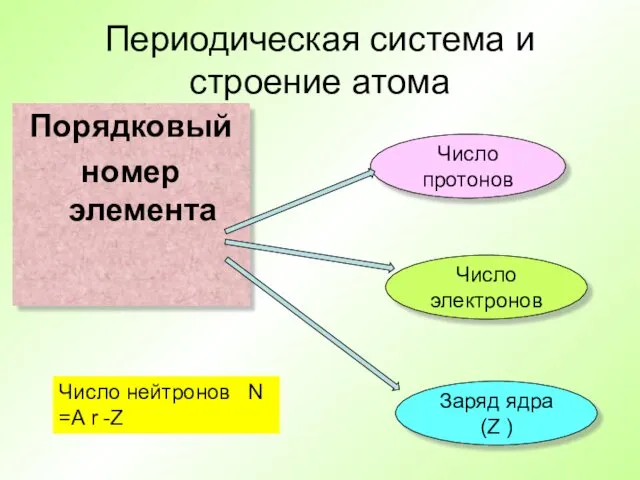
- 19. Периодическая система и строение атома Порядковый номер элемента Число протонов Число электронов Заряд ядра (Z )
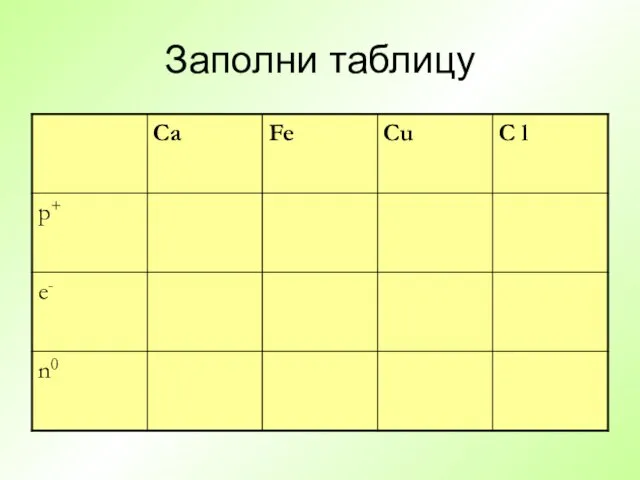
- 20. Заполни таблицу
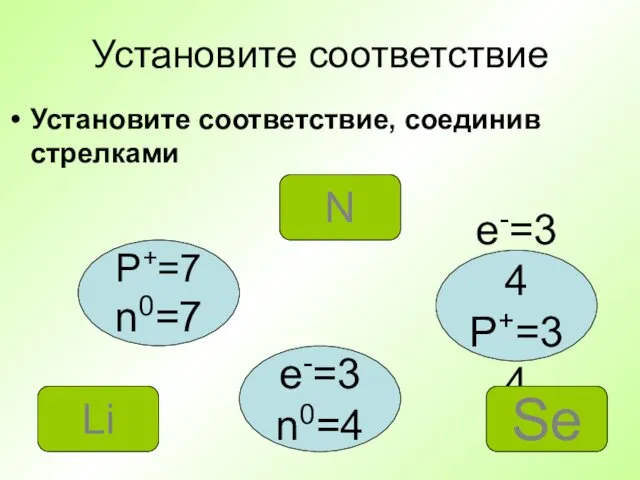
- 21. Установите соответствие Установите соответствие, соединив стрелками P+=7 n0=7 e-=34 P+=34 e-=3 n0=4 N Se Li
- 22. Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер
- 24. Скачать презентацию







 Игра Доскажи словечко
Игра Доскажи словечко Презентация Формирование патриотических чувств дошкольников посредством использования краеведческого ресурса родного села.
Презентация Формирование патриотических чувств дошкольников посредством использования краеведческого ресурса родного села. Моделирование, формализация, визуализация
Моделирование, формализация, визуализация Компьютерные технологии в образовании
Компьютерные технологии в образовании Қазақстандағы инфекциялық ғылымның қалыптасу тарихы
Қазақстандағы инфекциялық ғылымның қалыптасу тарихы Русский богатырь
Русский богатырь Прямоугольный параллелепипед
Прямоугольный параллелепипед Оборудование для приготовления и продажи напитков
Оборудование для приготовления и продажи напитков Victory Day
Victory Day Сложение и вычитание двузначных чисел
Сложение и вычитание двузначных чисел ИЗО. Сказочный домик
ИЗО. Сказочный домик Державин Гавриил Романович
Державин Гавриил Романович О компании. Группа компаний Русавтодор
О компании. Группа компаний Русавтодор Презентация Огород-круглый год
Презентация Огород-круглый год Эффективное применение новых педагогических технологий как условие повышения качества образования
Эффективное применение новых педагогических технологий как условие повышения качества образования Математический КВН между 7 классами
Математический КВН между 7 классами Межпредметная игра Что?Где? Когда?
Межпредметная игра Что?Где? Когда? Интерактивные технологии в воспитательном процессе
Интерактивные технологии в воспитательном процессе Функции жалюзи
Функции жалюзи 9 Мая - День Победы (открытки учеников)
9 Мая - День Победы (открытки учеников) Амперметр и вольтметр
Амперметр и вольтметр игра в 5 классе
игра в 5 классе Районное методическое объединение познайка
Районное методическое объединение познайка 1-е и 2-е Послания к Фессалоникийцам (Солунянам) апостола Павла
1-е и 2-е Послания к Фессалоникийцам (Солунянам) апостола Павла Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли урок по географии 9 класс, по теме Научный комплекс.
урок по географии 9 класс, по теме Научный комплекс. Культура Древнего Египта
Культура Древнего Египта Ярославская область. Основные социально-экономические показатели
Ярославская область. Основные социально-экономические показатели