Содержание
- 2. План лекции Свойства аминокислот Химический состав белков Первичная структура
- 3. Свойства аминокислот
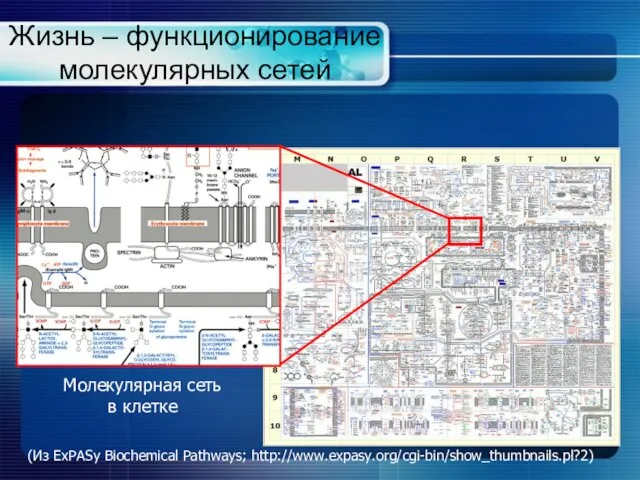
- 4. Жизнь – функционирование молекулярных сетей Молекулярная сеть в клетке (Из ExPASy Biochemical Pathways; http://www.expasy.org/cgi-bin/show_thumbnails.pl?2)
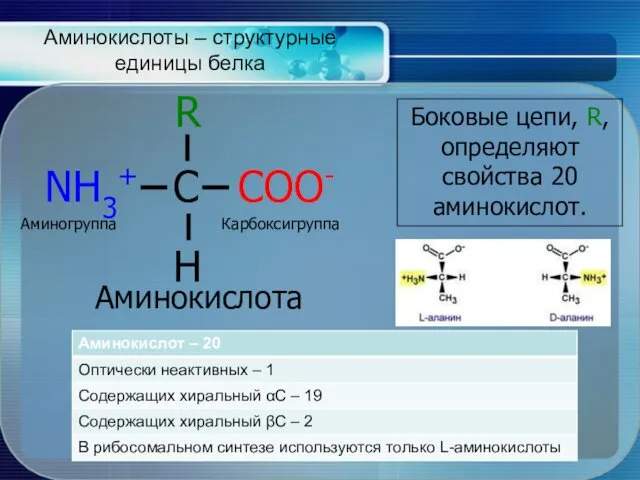
- 5. Аминокислоты – структурные единицы белка Аминокислота Боковые цепи, R, определяют свойства 20 аминокислот. Аминогруппа Карбоксигруппа
- 6. 20 аминокислот Glycine (G) Glutamic acid (E) Asparatic acid (D) Methionine (M) Threonine (T) Serine (S)
- 7. задача Сколько полипептидных последовательностей с длиной полипептидной цепи 5 аминокислотных остатков можно составить из оптически активных
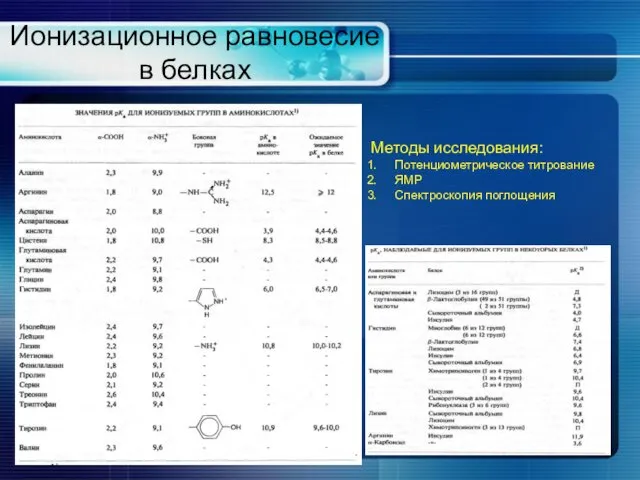
- 8. Ионизационное равновесие в белках Методы исследования: Потенциометрическое титрование ЯМР Спектроскопия поглощения
- 9. Ионизация амино- и карбоксильных групп При рН 7.0: α-аминогруппа протонирована (+) α-карбоксильная группа депротонирована (-) Аминокислоты
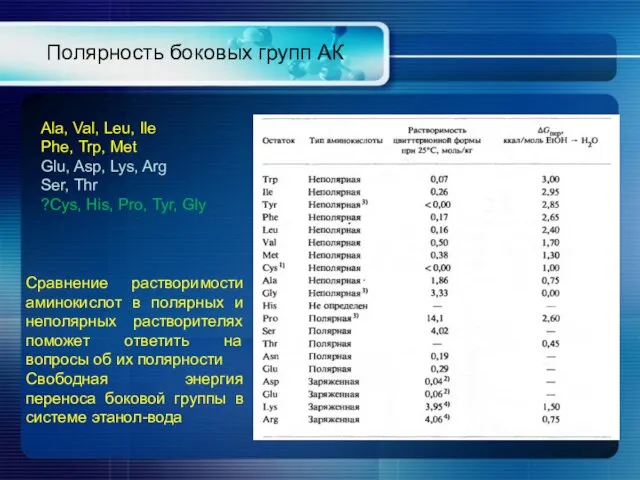
- 10. Полярность боковых групп АК Ala, Val, Leu, Ile Phe, Trp, Met Glu, Asp, Lys, Arg Ser,
- 11. Химический состав белков
- 12. Шкала средней гидрофобности белков 0,44-2,02 кКал/моль Аминокислотный состав Автоматические методы анализа АК состава АК Редкие Обычные
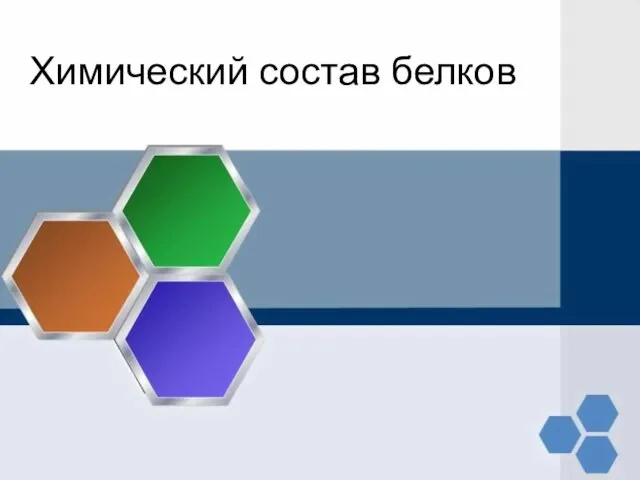
- 13. Предсказание свойств белков по аминокислотному составу Разграничение внутренних и внешних мембранных белков с помощью дискриминантной функции
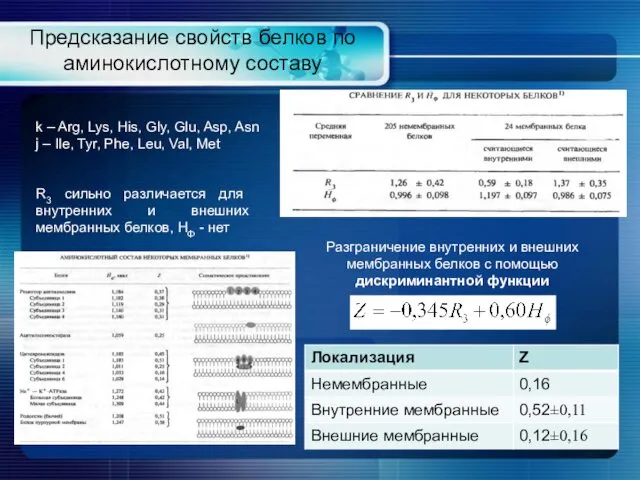
- 14. Аминокислотный состав некоторых мембранных белков
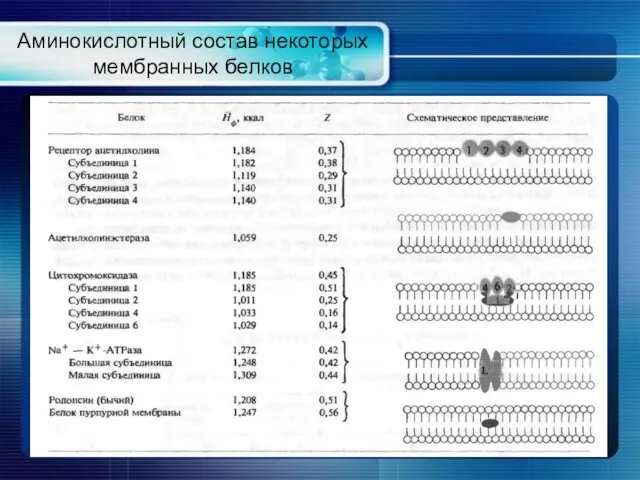
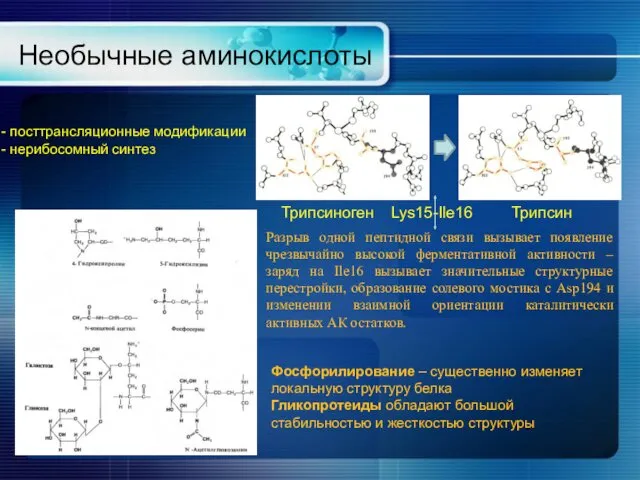
- 15. Необычные аминокислоты Трипсиноген Трипсин Lys15-Ile16 Разрыв одной пептидной связи вызывает появление чрезвычайно высокой ферментативной активности –
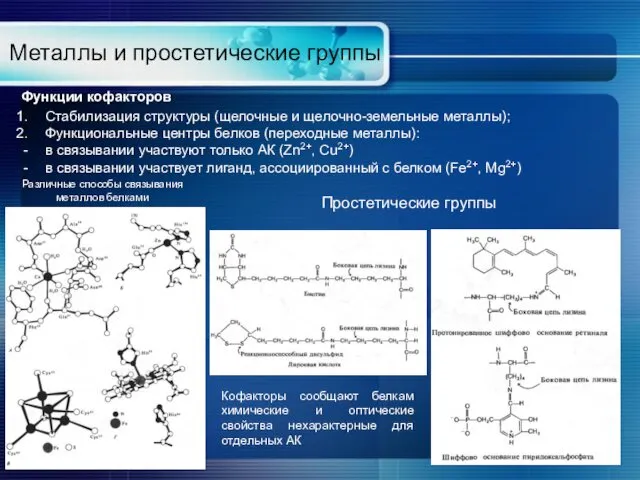
- 16. Металлы и простетические группы Стабилизация структуры (щелочные и щелочно-земельные металлы); Функциональные центры белков (переходные металлы): в
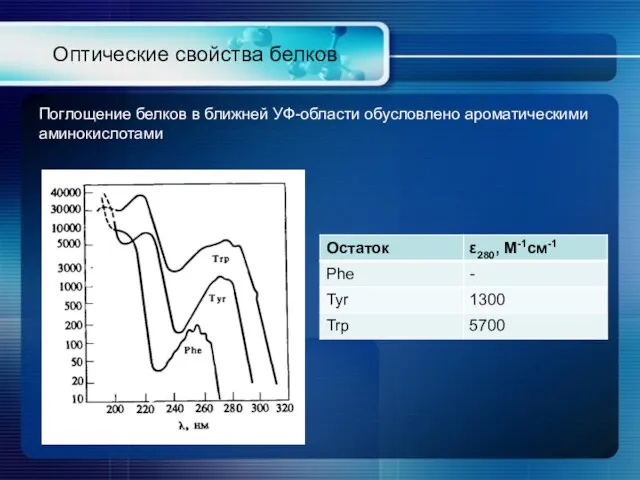
- 17. Оптические свойства белков Поглощение белков в ближней УФ-области обусловлено ароматическими аминокислотами
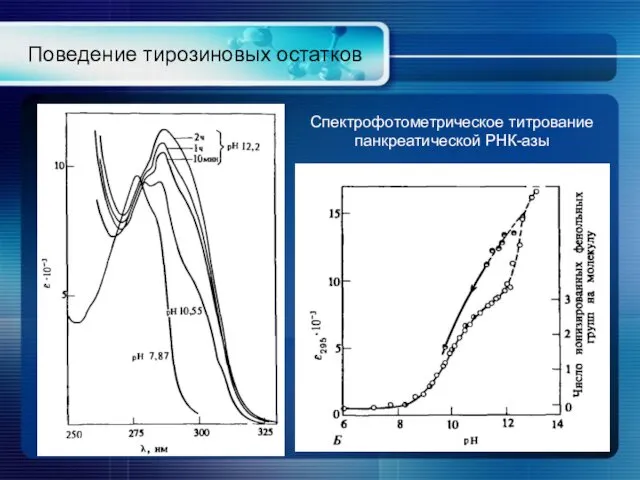
- 18. Поведение тирозиновых остатков Спектрофотометрическое титрование панкреатической РНК-азы
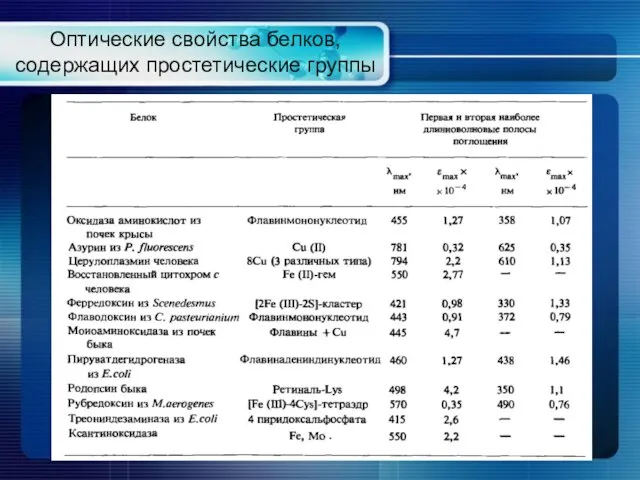
- 19. Оптические свойства белков, содержащих простетические группы
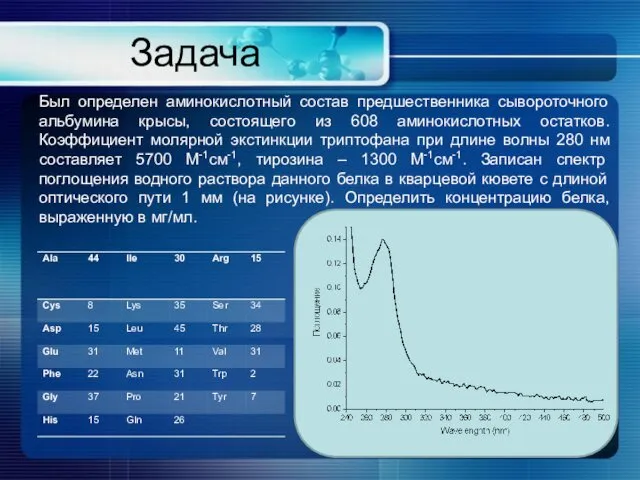
- 20. Задача Был определен аминокислотный состав предшественника сывороточного альбумина крысы, состоящего из 608 аминокислотных остатков. Коэффициент молярной
- 21. Первичная структура
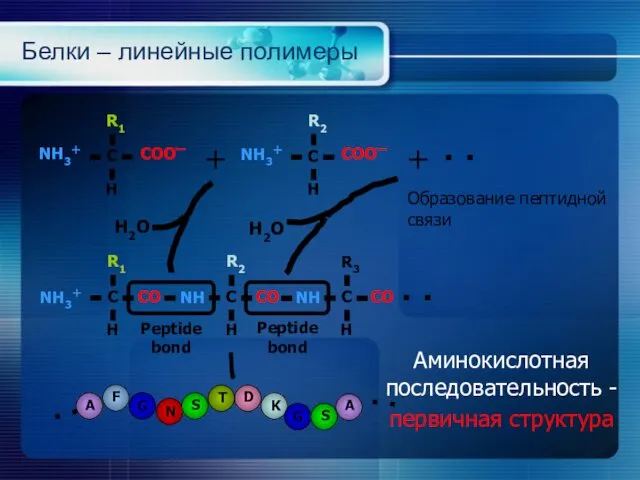
- 22. Белки – линейные полимеры R1 NH3+ C CO H R2 NH C CO H R3 NH
- 23. Дисульфидные и другие поперечные связи Система связей в цистине нелинейна и имеет неплоскую конформацию Белки: Не
- 24. Задача Молекулярная масса неизвестного белка, определенная с использованием метода масс-спектрометрии, составила 56 кДа. Аминокислотный анализ показал,
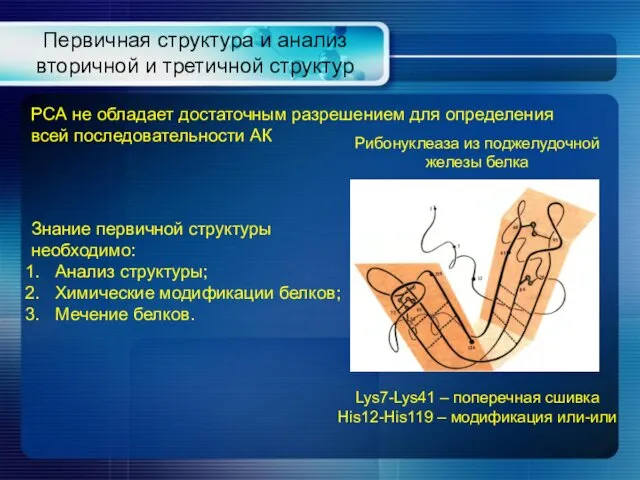
- 25. Первичная структура и анализ вторичной и третичной структур РСА не обладает достаточным разрешением для определения всей
- 26. Первичная структура и предсказание вторичной и третичной структур Распределение различных типов вторичной структуры в аденилаткиназе
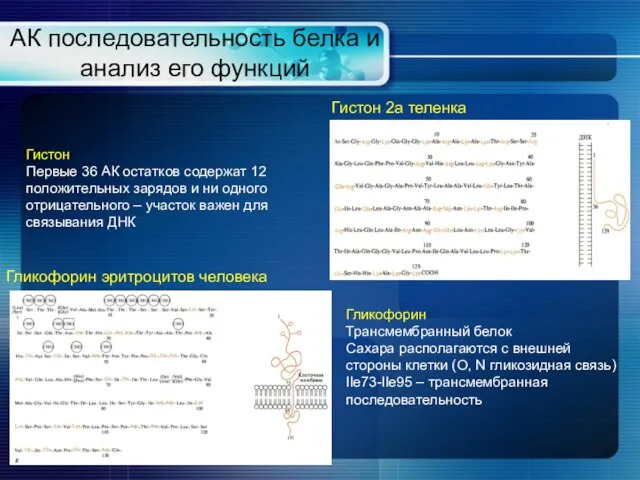
- 27. АК последовательность белка и анализ его функций Гликофорин эритроцитов человека Гистон 2а теленка Гликофорин Трансмембранный белок
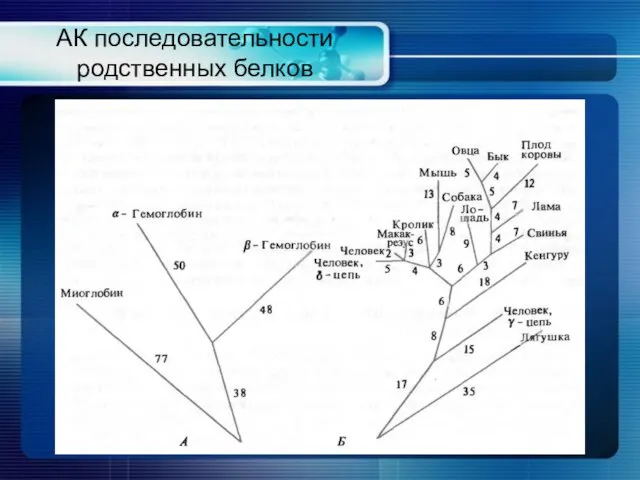
- 28. АК последовательности родственных белков
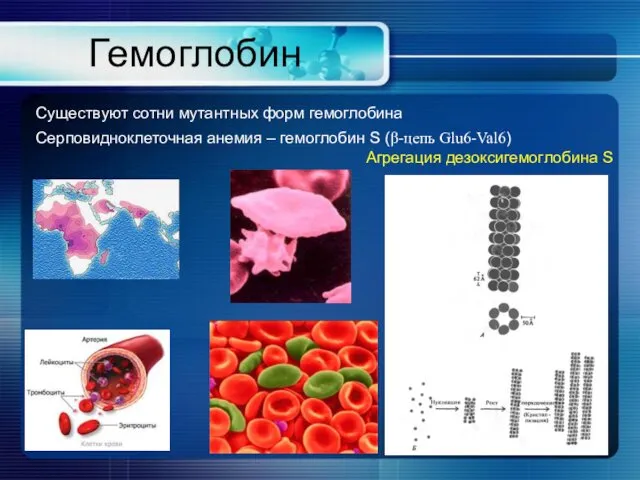
- 29. Гемоглобин Существуют сотни мутантных форм гемоглобина Серповидноклеточная анемия – гемоглобин S (β-цепь Glu6-Val6) Агрегация дезоксигемоглобина S
- 31. Скачать презентацию










 МК комп старт
МК комп старт Система технического зрения робота на основе микроконтроллера
Система технического зрения робота на основе микроконтроллера Презентация Использование ИКТ в работе с родителями
Презентация Использование ИКТ в работе с родителями Использование блоков З. Дьенеша для развития логических операций мышления в дошкольном возрасте.
Использование блоков З. Дьенеша для развития логических операций мышления в дошкольном возрасте. Электрические цепи переменного тока. Лекция 1
Электрические цепи переменного тока. Лекция 1 Китай
Китай Древесина. Пиломатериалы и древесные материалы
Древесина. Пиломатериалы и древесные материалы Немного о себе
Немного о себе Религиозная живопись
Религиозная живопись 10. Обработка результатов измерений
10. Обработка результатов измерений Как воспитать в ребенке читателя
Как воспитать в ребенке читателя Презентация УМК Начальная школа XXI века
Презентация УМК Начальная школа XXI века Etymology. Adjective
Etymology. Adjective ОРКСЭ Основы православной культуры 4 класс. Урок Милосердие и сострадание
ОРКСЭ Основы православной культуры 4 класс. Урок Милосердие и сострадание Презентация Права ребёнка
Презентация Права ребёнка Платформы. Конструкция, основные элементы, дополнительные элементы, особенности контструкции
Платформы. Конструкция, основные элементы, дополнительные элементы, особенности контструкции Сепсис. Этиология
Сепсис. Этиология Запечатлевающая фотография
Запечатлевающая фотография Исследование ОУ и схем их включения. Лабораторная работа №2
Исследование ОУ и схем их включения. Лабораторная работа №2 Alexeeva
Alexeeva Технологические процессы устройства отделочных покрытий
Технологические процессы устройства отделочных покрытий Класс паукообразные
Класс паукообразные Обеспечение безопасности при использовании и содержании внутридомового и внутриквартирного газового оборудования
Обеспечение безопасности при использовании и содержании внутридомового и внутриквартирного газового оборудования Презентация-игра М.В.Ломоносов
Презентация-игра М.В.Ломоносов Метод координат в пространстве
Метод координат в пространстве Презентация Растения Астраханской области
Презентация Растения Астраханской области Жизнь под угрозой.
Жизнь под угрозой. Сүт өнімдері биотехнологиясы
Сүт өнімдері биотехнологиясы