Содержание
- 2. Содержание Периодическая система элементов Заряд ядра и радиус атома Металлические свойства и неметаллические свойства Энергия ионизации
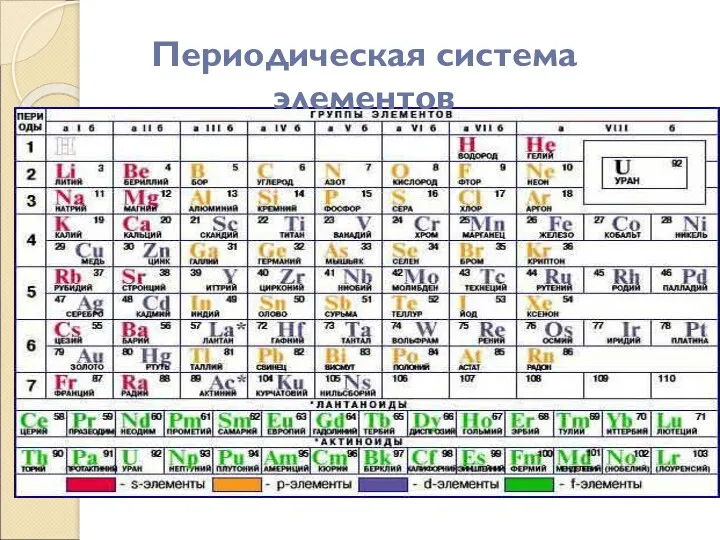
- 3. Периодическая система элементов
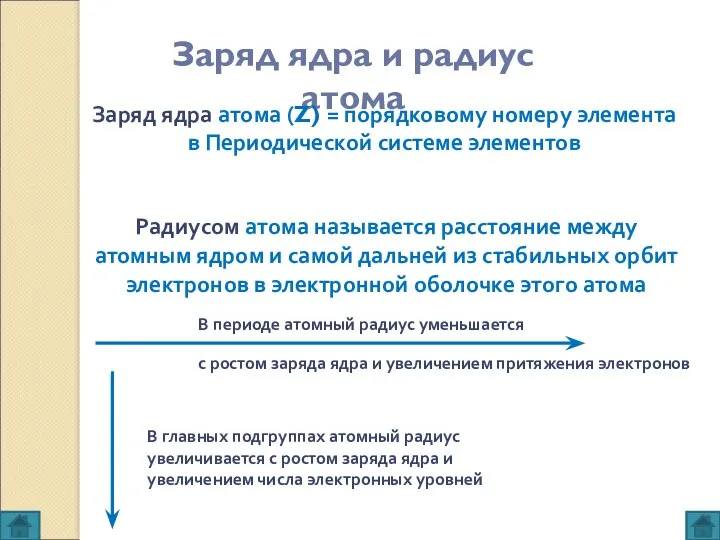
- 4. Заряд ядра и радиус атома Заряд ядра атома (Z) = порядковому номеру элемента в Периодической системе
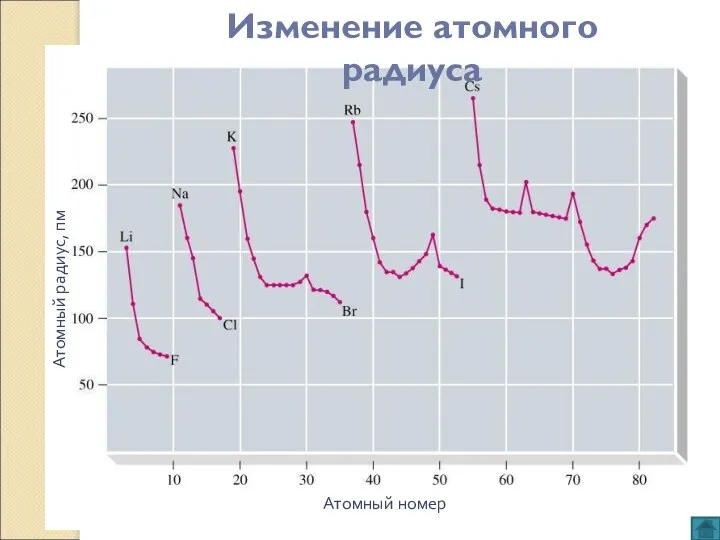
- 5. Атомный номер Атомный радиус, пм Изменение атомного радиуса
- 6. Металлические и неметаллические свойства Ме - ne → Меn+ Металлические свойства - это свойство отдавать электроны
- 7. Энергия ионизации Энергией ионизации называют количество энергии, которое надо затратить, чтобы оторвать электрон от атома В
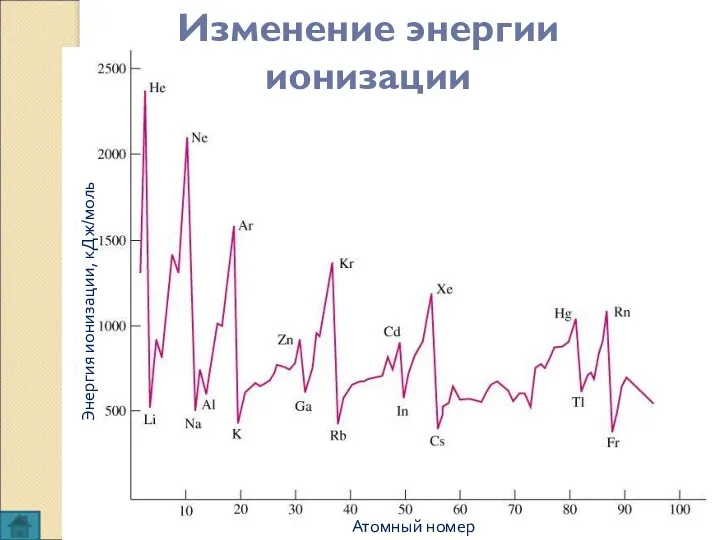
- 8. Изменение энергии ионизации Атомный номер Энергия ионизации, кДж/моль
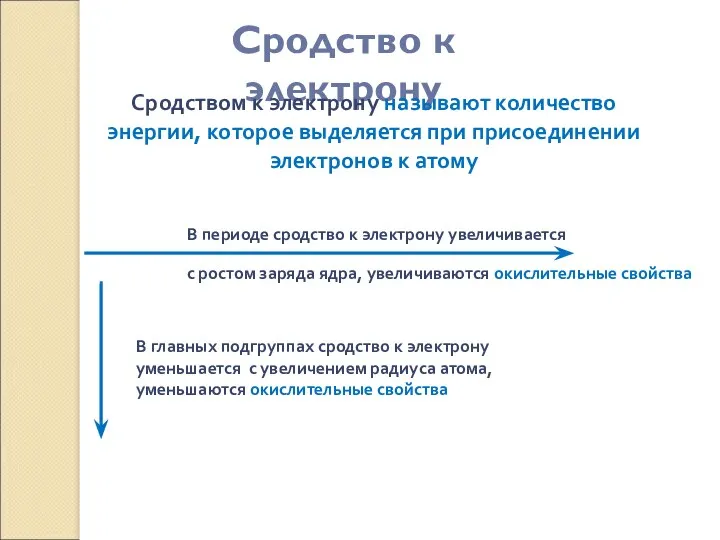
- 9. Сродство к электрону Сродством к электрону называют количество энергии, которое выделяется при присоединении электронов к атому
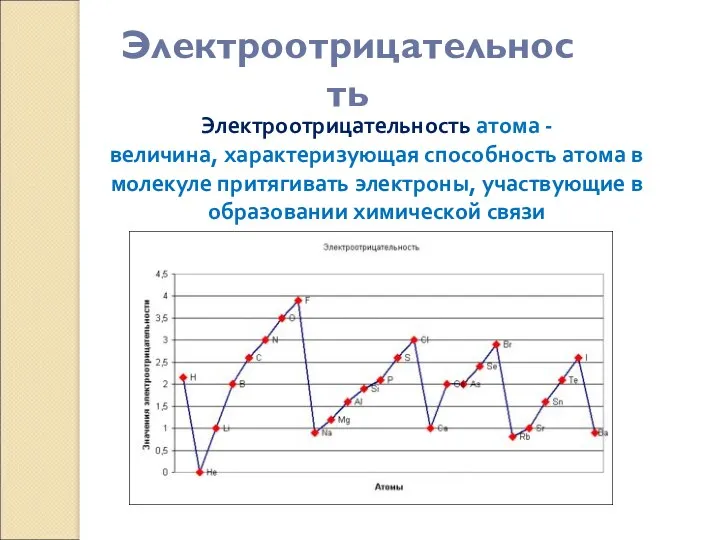
- 10. Электроотрицательность Электроотрицательность атома - величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической
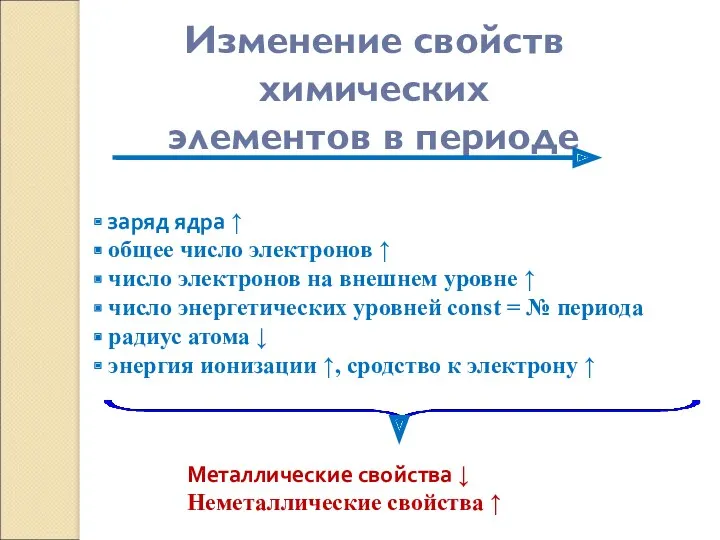
- 11. Изменение свойств химических элементов в периоде заряд ядра ↑ общее число электронов ↑ число электронов на
- 12. Изменение свойств химических элементов в главной подгруппе заряд ядра ↑ общее число электронов ↑ число электронов
- 13. Валентность Валентность (от лат. Valentia - сила) - способность атома присоединять или замещать определённое число атомов
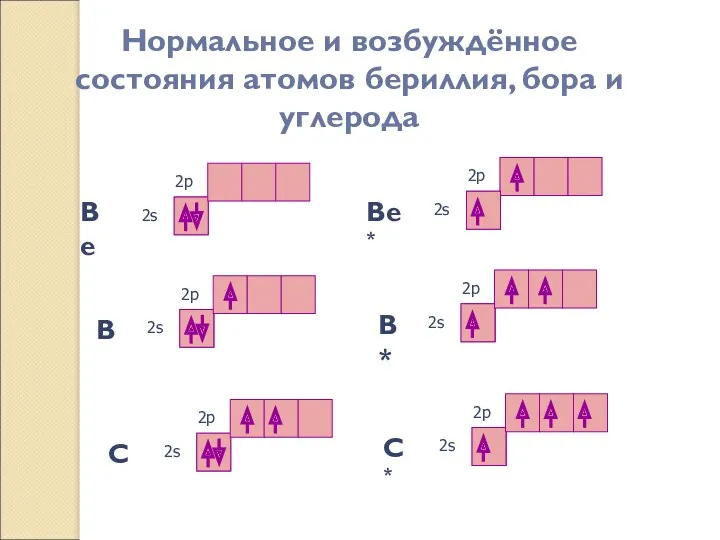
- 14. Нормальное и возбуждённое состояния атомов бериллия, бора и углерода Be* 2s 2p Be 2s 2p B
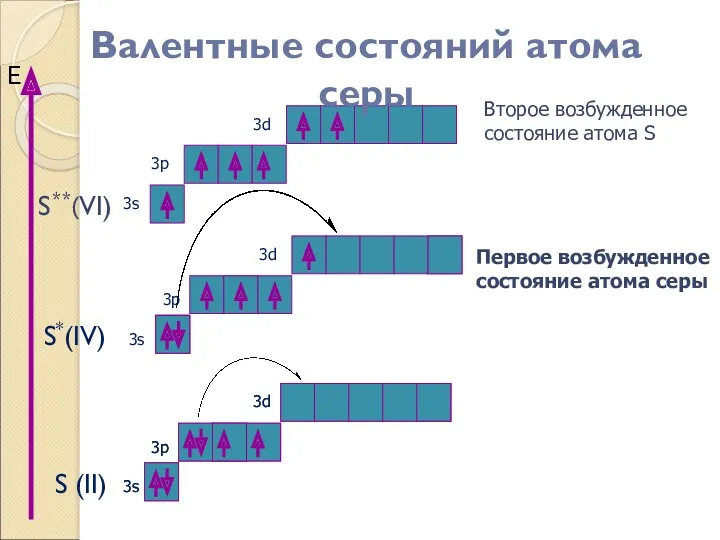
- 15. S**(VI) S (II) S*(IV) Е 3s 3p 3s 3p 3s 3p 3d 3d 3d Второе возбужденное
- 17. Скачать презентацию





 Окислительно-восстановительные реакции - электронная презентация для подготовки учащихся к выполнению задания С1 на ЕГЭ по химии
Окислительно-восстановительные реакции - электронная презентация для подготовки учащихся к выполнению задания С1 на ЕГЭ по химии Презентация - краеведческая викторина _Земля Ульяновская_
Презентация - краеведческая викторина _Земля Ульяновская_ игра сложи ракету
игра сложи ракету 20231016_zadachi_po_molekul._biologii_i_energozatratam_dlya_9_kl_microsoft_powerpoint
20231016_zadachi_po_molekul._biologii_i_energozatratam_dlya_9_kl_microsoft_powerpoint Цвет как средство выражения: тихие (глухие) и звонкие цвета
Цвет как средство выражения: тихие (глухие) и звонкие цвета Рабочий проект Жилая застройка
Рабочий проект Жилая застройка Общие положения об обязательствах
Общие положения об обязательствах Презентация Глобальные проблемы человечества
Презентация Глобальные проблемы человечества Доктор Яша из Огненного выпуска. Яков Григорьевич Ченибалаев
Доктор Яша из Огненного выпуска. Яков Григорьевич Ченибалаев кинодискуссия - как
кинодискуссия - как Доставка генетических конструкций в клетки человека. (Лекция 6)
Доставка генетических конструкций в клетки человека. (Лекция 6) Песнь о Роланде
Песнь о Роланде Исследование в области гуманитарных наук
Исследование в области гуманитарных наук презентация Правописание НЕ с именами существительными
презентация Правописание НЕ с именами существительными 10 ошибок в воспитании, которые все когда-нибудь совершали
10 ошибок в воспитании, которые все когда-нибудь совершали Основные положения теории логистики. Основные понятия и определения
Основные положения теории логистики. Основные понятия и определения Игра, как средство развития воображения и мышления у детей с ОВЗ
Игра, как средство развития воображения и мышления у детей с ОВЗ Семинар Добро пожаловать в проектные технологии!
Семинар Добро пожаловать в проектные технологии! Роль кожи в терморегуляции организма
Роль кожи в терморегуляции организма The “europolis” residential complex: a fantasy in palladian style traditions
The “europolis” residential complex: a fantasy in palladian style traditions Задания по сольфеджио и слушанию музыки для 1 класса
Задания по сольфеджио и слушанию музыки для 1 класса Посвящается учителям
Посвящается учителям Награда за терпение
Награда за терпение ПРЕЗЕНТАЦИЯ ЗАНИМАТЕЛЬНЫЙ ТРУД - ПОДЕЛКИ ИЗ ПРИРОДНОГО МАТЕРИАЛА
ПРЕЗЕНТАЦИЯ ЗАНИМАТЕЛЬНЫЙ ТРУД - ПОДЕЛКИ ИЗ ПРИРОДНОГО МАТЕРИАЛА Упрощение выражений
Упрощение выражений Режим труда и отдыха старшеклассников
Режим труда и отдыха старшеклассников Беременность и заболевания сердечно-сосудистой системы. Лекция 7
Беременность и заболевания сердечно-сосудистой системы. Лекция 7 Бизнес-план. Индивидуальное предприятие
Бизнес-план. Индивидуальное предприятие