Содержание
- 2. Содержание Свойства связи Длина связи Энергия связи Полярность Поляризуемость Направленность Насыщаемость
- 3. Характерные свойства ковалентной связи определяют химические и физические свойства органических соединений Свойства связи
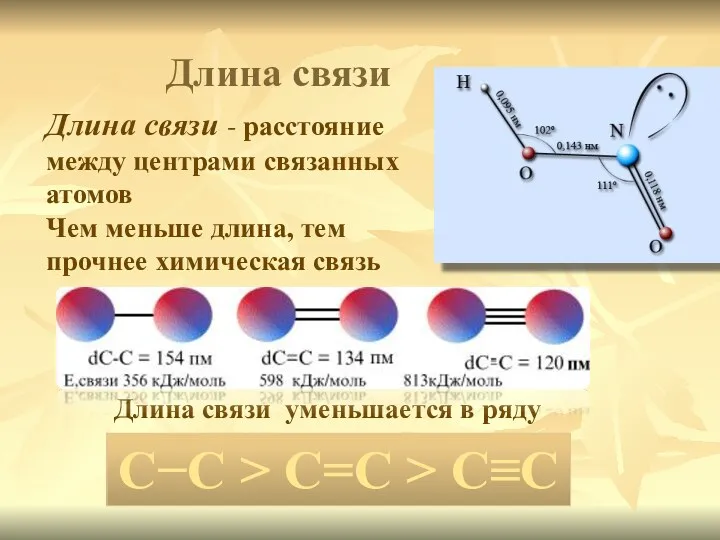
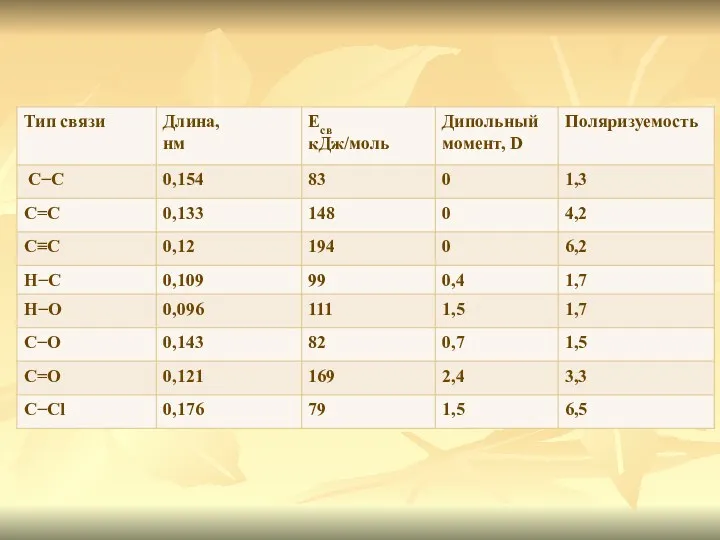
- 4. Длина связи - расстояние между центрами связанных атомов Чем меньше длина, тем прочнее химическая связь Длина
- 5. Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов Энергия
- 6. Прочность связи обычно уменьшается с увеличением ее длины
- 7. Полярность связи Дипольный момент связи (μ) (векторная величина, характеризующая полярность связи) - произведение её длины на
- 8. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам Поляризуемость связи
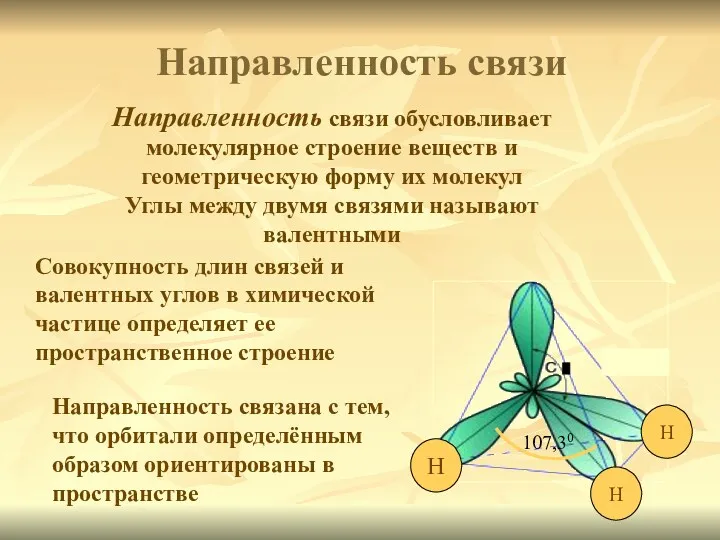
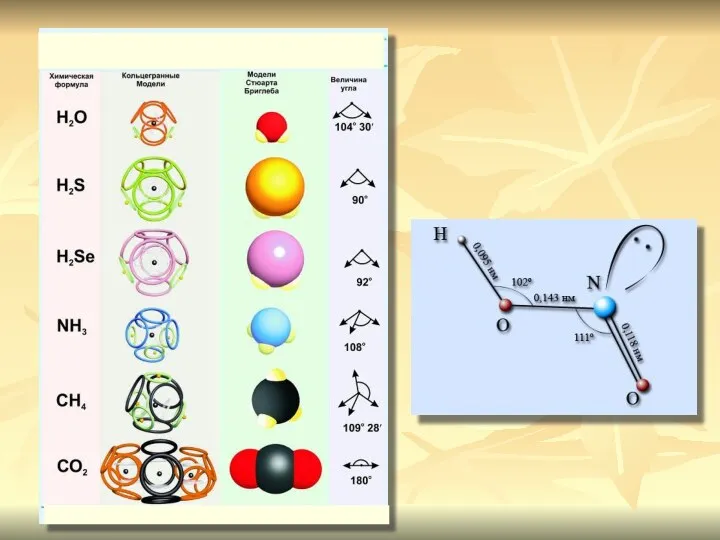
- 10. Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул Углы между двумя связями называют
- 12. Насыщаемость связи Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей Насыщаемость – способность атома
- 14. Скачать презентацию







 Технологические и эксплуатационные свойства материалов
Технологические и эксплуатационные свойства материалов Русский жестовый язык
Русский жестовый язык Поиграем в карты Проппа
Поиграем в карты Проппа Массаж по Дьяковой Е.А.
Массаж по Дьяковой Е.А. Расчет и конструирование крупнопанельных зданий
Расчет и конструирование крупнопанельных зданий ТС сигналын қалыптастыру және тарату кезіндегі желілік пункт құрылғыларының жұмысы
ТС сигналын қалыптастыру және тарату кезіндегі желілік пункт құрылғыларының жұмысы Техническое регулирование в Российской Федерации
Техническое регулирование в Российской Федерации Учет неопределенности и риска в проекте
Учет неопределенности и риска в проекте Стихокомплексы
Стихокомплексы Спортивное ориентирование. Пеший туризм
Спортивное ориентирование. Пеший туризм Сетевые черви и защита от них
Сетевые черви и защита от них Заповеди блаженства
Заповеди блаженства Обитатели морей России
Обитатели морей России Методы очистки природных и сточных вод
Методы очистки природных и сточных вод Оборудование для герметизации устья скважины
Оборудование для герметизации устья скважины Завдання судової автотехнічної експертизи
Завдання судової автотехнічної експертизи Средства, влияющие на сердечнососудистую систему
Средства, влияющие на сердечнососудистую систему Медицинская защита населения и спасателей в чрезвычайных ситуациях
Медицинская защита населения и спасателей в чрезвычайных ситуациях Леонид Иванович Воинов (1898-1967)
Леонид Иванович Воинов (1898-1967) Направления эволюции
Направления эволюции Опыты с водой
Опыты с водой Обязательное социальное медицинское страхование
Обязательное социальное медицинское страхование Золотое кольцо России. Что называется золотым кольцом России?
Золотое кольцо России. Что называется золотым кольцом России? Вода на Земле. Гидросфера
Вода на Земле. Гидросфера Что такое добро
Что такое добро Экономический потенциал Амурской области
Экономический потенциал Амурской области Интерфейс графических устройств GDI
Интерфейс графических устройств GDI Теоретическая подготовка водителей категории С Основы законодательства в сфере дорожного движения
Теоретическая подготовка водителей категории С Основы законодательства в сфере дорожного движения