Содержание
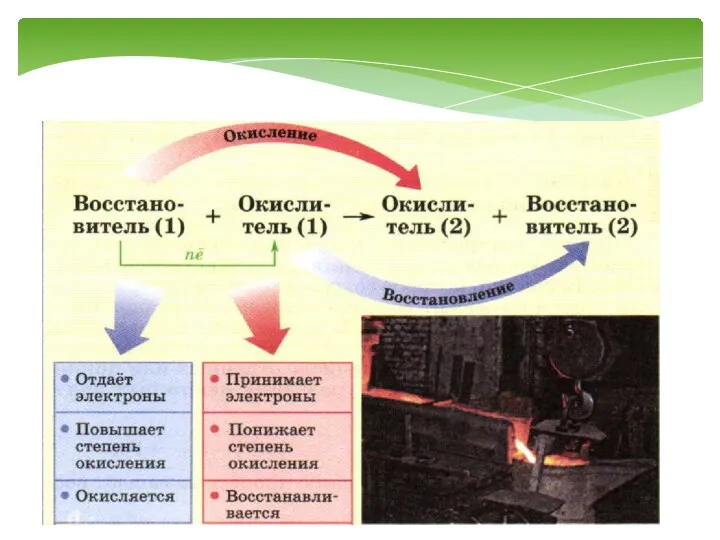
- 2. Окислительно – восстановительные реакции
- 3. Попробуйте составить схемы, которые отражали бы изменения степеней окисления у элементов. Почему изменяется степень окисления? Как
- 4. Проверим, что получилось 2К N O3 + S + 3C = К2 S + N2 +
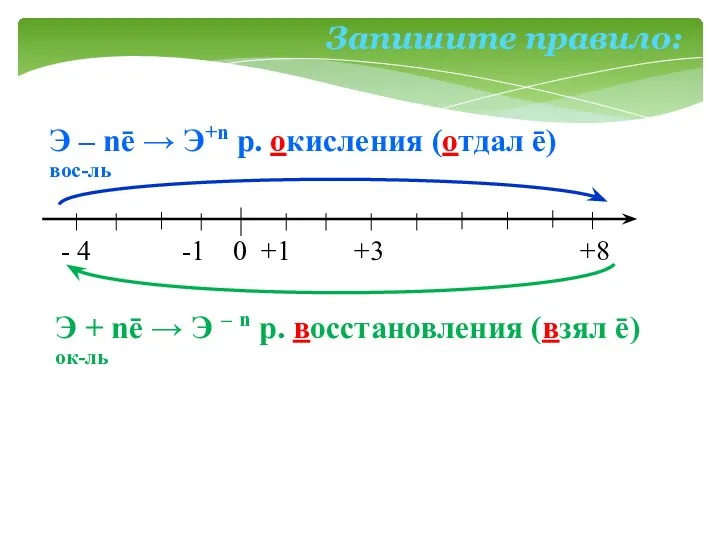
- 5. - 4 -1 0 +1 +3 +8 Э – nē → Э+n р. окисления (отдал ē)
- 7. В уравнениях реакций расставьте степени окисления элементов. Укажите, является ли реакция ОВР. Укажите элемент окислитель и
- 8. Реакции, в которых окислителем и восстановителем является один элемент называются реакциями диспропорционирования Запишите определение
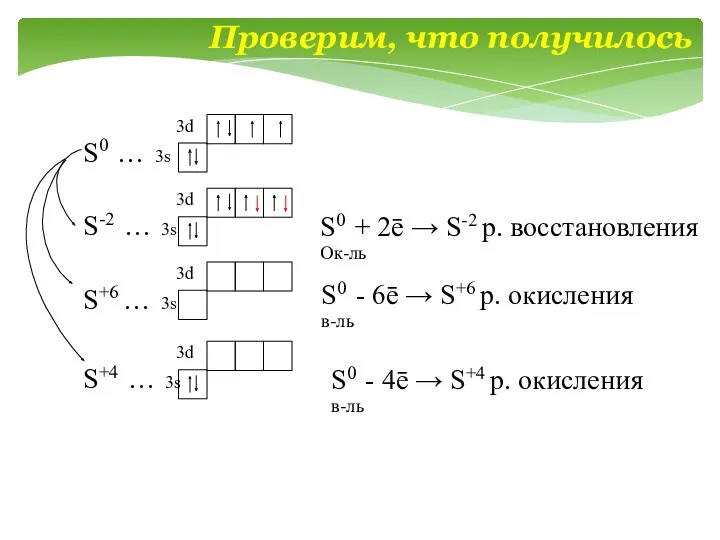
- 9. Выполните задание Задание: Составьте валентную схему атома серы в основном состоянии: Составьте валентную схему атома серы,
- 10. S0 … 3s 3d S-2 … 3s 3d S+6 … 3s 3d S+4 … 3s 3d
- 11. Окислители – элементы в высших степенях окисления: Н2SО4, НNО3, KMnO4, K2Cr2O7 Cl2 (до Cl–), O2 (
- 12. Обсудите в паре, какие из приведённого ниже списка полуреакции относятся к окислению, какие к восстановлению и
- 13. Соблюдая инструкцию проведите опыты по группам и расскажите о результатах товарищам в виде схем, таблиц. Лабораторная
- 14. I2 + сильный восстановитель 2I– коричнев. р-р бесцветный р-р КMnO4 в кислой среде (НХ) MnX (соль)
- 15. Домашнее задание §§16, 17 Жилин Д.М. Учебник. Химия 9 класс. 1 ч. Электронный тренажер http://fcior.edu.ru Домашний
- 17. Скачать презентацию











 Разработка технологических процессов изготовления деталей машин
Разработка технологических процессов изготовления деталей машин Гигиена окружающей среды (1)
Гигиена окружающей среды (1) Социальная политика ТРАНСАЭРО
Социальная политика ТРАНСАЭРО Взаимодействие предприятий при аутсорсинге
Взаимодействие предприятий при аутсорсинге Электросинтез (электрохимический синтез)
Электросинтез (электрохимический синтез) Компьютер – основной инструмент подготовки текстов
Компьютер – основной инструмент подготовки текстов Inventronics. Информация о компании
Inventronics. Информация о компании Организация управления и взаимодействия в специальных операциях
Организация управления и взаимодействия в специальных операциях Кир Булычев. Путешествие Алисы
Кир Булычев. Путешествие Алисы Компания Lamborghini
Компания Lamborghini Долговечность бетона
Долговечность бетона Географическое положение Южной Америки
Географическое положение Южной Америки Здоровый образ жизни
Здоровый образ жизни Немецкая овчарка
Немецкая овчарка Структура, морфология культуры. Типология культуры
Структура, морфология культуры. Типология культуры чем заняться на карантине
чем заняться на карантине Проблемы табакокурения в подростковом возрасте
Проблемы табакокурения в подростковом возрасте Классный уголок Солнышко
Классный уголок Солнышко Платина. Знаходження в періодичній системі і основні характеристики
Платина. Знаходження в періодичній системі і основні характеристики Управление персоналом
Управление персоналом Программа коррекционной работы логопеда
Программа коррекционной работы логопеда Сенсорное воспитание детей младшего дошкольного возраста
Сенсорное воспитание детей младшего дошкольного возраста МАОУ СОШ №40 имени М. К. Видова г. Новороссийска
МАОУ СОШ №40 имени М. К. Видова г. Новороссийска Кроссворд Вечная Слава городам-героям
Кроссворд Вечная Слава городам-героям Чем полезно бисероплетение для детей
Чем полезно бисероплетение для детей Ряд dinoflagellida. Панцирні прісноводні і морські планктонні джгутикові
Ряд dinoflagellida. Панцирні прісноводні і морські планктонні джгутикові Клуб интернациональной дружбы
Клуб интернациональной дружбы Макаронные изделия
Макаронные изделия