Теория и практика решения задач высокого уровня сложности в процессе обучения химии (на материале темы Генетическая связь органических соединений) презентация
Содержание
- 2. В курсе изучения органической химии часто применяются задания по выполнению цепочек превращений. Они используются в 9
- 3. Цель. Содействовать формированию у учащихся более высокого уровня сложности общей подготовки по вопросу генетическая связь между
- 4. Что означает понятие “генетическая связь”? Генетической связью называется связь между веществами разных классов соединений, основанная на
- 5. Для того чтобы успешно выполнять задания, показывающие генетические связи между классами органических веществ, на уроках химии
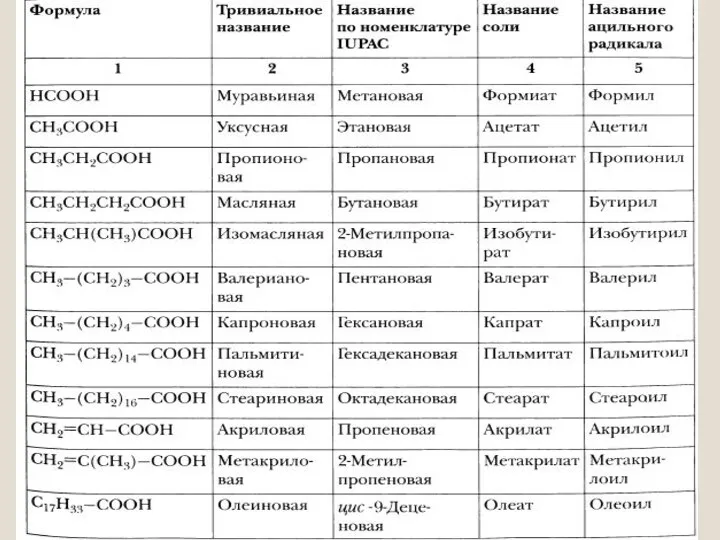
- 6. Номенклатура и классификация В вопросе изучения номенклатуры и классификации органических веществ можно создать карту формул соединений
- 7. Карта формул химических соединений (карта формул напечатана в сокращении) 1) H – COOH метановая кислота, муравьиная
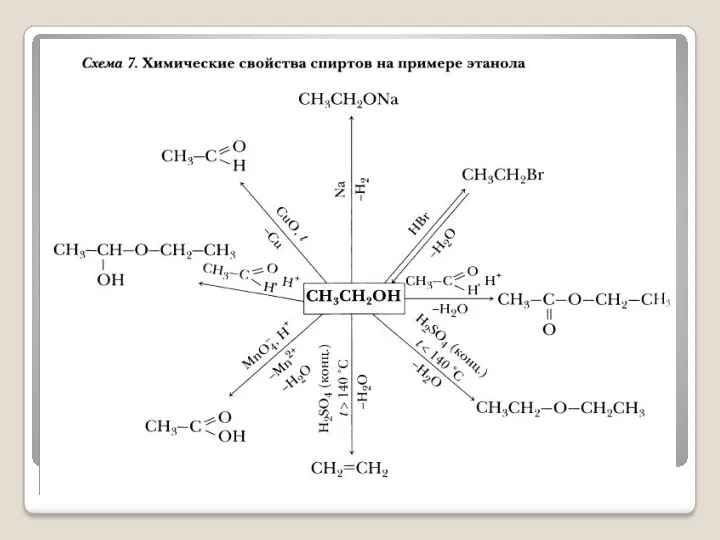
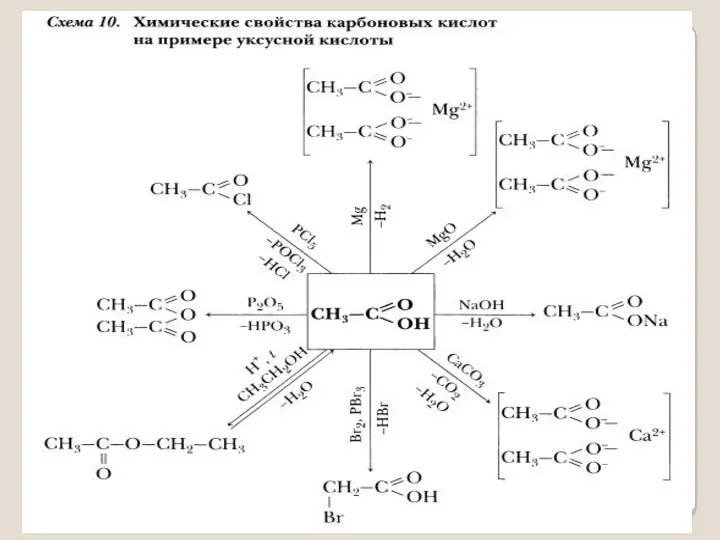
- 9. Изучение химических свойств и способов получения органических соединений. При изучении этих вопросов на уроках можно применять
- 12. С6Н12О6→ С2Н5ОН → CH3 – CHO → CH3 – COOH → Cl-CH2 – COOH → Н2N–CH2
- 13. Успешность в выполнении заданий будет зависеть от количества осуществленных превращений 1) CaC2 → X1 → X2
- 16. Чаще всего сущность задания заключается в последовательном решении следующих задач: построение (удлинение или укорачивание) углеродного скелета;
- 17. Памятка Представьте факты и их взаимосвязи в наглядном виде. Запишите, по возможности наиболее подробно, суть задачи
- 18. С помощью каких реакций можно осуществить превращения по схеме: СН3СООNa→CH3 – CH3→CH2=CH2→ CH2Br– CH2Br → CH≡CH→KOOC
- 19. 5. Этин обесцвечивает водный раствор KMnO4: 3CH≡CH +8 KMnO4→3 KOOC – COOK + + 8 MnO2
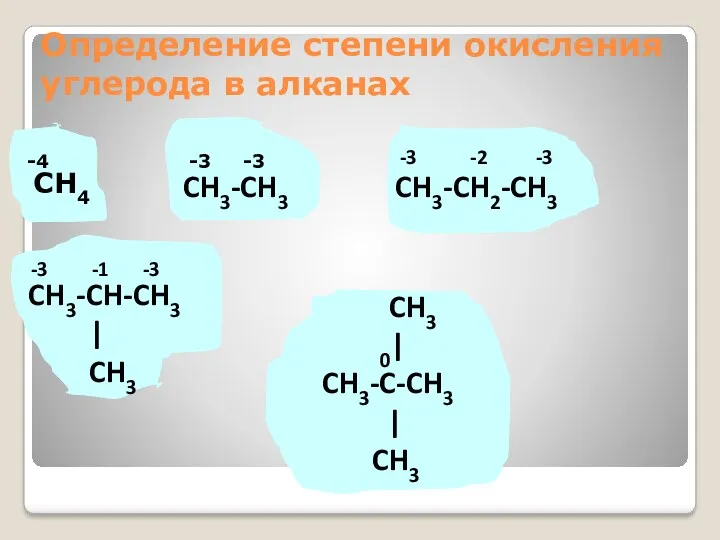
- 20. Определение степени окисления углерода в алканах -4 -3 -3 CH4 CH3-CH3 CH3-CH2-CH3 -3 -2 -3 CH3-CH-CH3
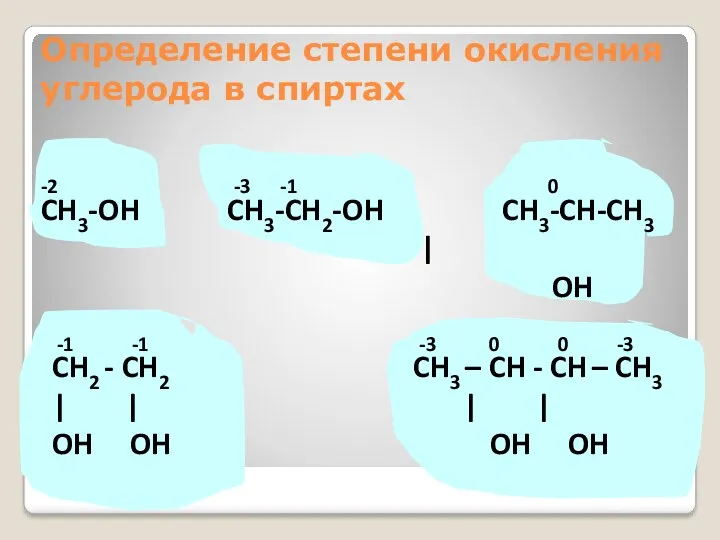
- 21. Определение степени окисления углерода в спиртах -2 -3 -1 0 CH3-OH CH3-CH2-OH CH3-CH-CH3 | OH -1
- 22. K2Cr2O7 Окислители KMnO4 [H+] Mn2+ [H2O] [OH-] MnO2 MnO4 2+ [H+] [H2O] Cr3+ Cr [OH]3
- 23. Процессы окисления алкена зависят от его строения и среды протекания реакции При окислении алкенов концентрированным раствором
- 24. Если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например, в молекуле
- 25. Способы расстановки коэффициентов в ОВР с участием органических веществ. С6Н5СН3 + KMnO4+H2SO4 С6Н5СООН+K2SO4+MnSO4 +H2O Подбираем
- 26. Коэффициенты можно подобрать также методом электронно-ионного баланса (методом полуреакций). С6Н5СН3+KMnO4+H2SO4→С6Н5СООН+ K2SO4+MnSO4 +H2O С6Н5СН3+2H2O– 6е- → С6Н5СООН+6Н+
- 27. Напишите уравнение реакции между пропиленом и перманганатом калия в нейтральной среде. Напишите уравнение реакции между бутеном-2
- 28. Заключение Знания учащихся в вопросах О взаимосвязях органических веществ по схеме: состав- строение - свойства Составления
- 30. Скачать презентацию















![K2Cr2O7 Окислители KMnO4 [H+] Mn2+ [H2O] [OH-] MnO2 MnO4 2+ [H+] [H2O] Cr3+ Cr [OH]3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/451484/slide-21.jpg)






 Презентация для часа общения 1 апреля -День птиц
Презентация для часа общения 1 апреля -День птиц Ацтеки. Культура ацтеков
Ацтеки. Культура ацтеков Внутреннее устройство ПК
Внутреннее устройство ПК Экологическая акция Берегите первоцветы
Экологическая акция Берегите первоцветы Социальный туризм. Приозерск - Старая Ладога
Социальный туризм. Приозерск - Старая Ладога Мотивация
Мотивация Подземные машины для бурения шпуров и скважин. (Лекция 15)
Подземные машины для бурения шпуров и скважин. (Лекция 15) Детский сад присмотра и оздоровления
Детский сад присмотра и оздоровления Сырье для производства строительной керамики
Сырье для производства строительной керамики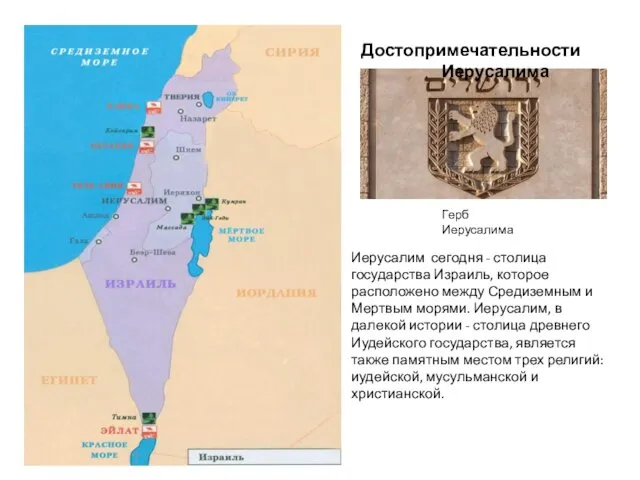 Достопримечательности Иерусалима
Достопримечательности Иерусалима Предприятия торговли как хозяйствующий субъект в рыночной экономике
Предприятия торговли как хозяйствующий субъект в рыночной экономике Аппаратное обеспечение современного компьютера
Аппаратное обеспечение современного компьютера Вентиляция и кондиционирование. Расчет расходов воздуха общеобменной вентиляции (РГЗ)
Вентиляция и кондиционирование. Расчет расходов воздуха общеобменной вентиляции (РГЗ) Сущность воспитания и его место в целостной структуре образовательного процесса
Сущность воспитания и его место в целостной структуре образовательного процесса Центральная Россия
Центральная Россия Вселенная. Планета Земля.
Вселенная. Планета Земля. Черты и сюжеты модерна
Черты и сюжеты модерна Презентации к курсу Химия и питание
Презентации к курсу Химия и питание Литературно-художественные издания
Литературно-художественные издания А смысл?
А смысл? Свойства действий с рациональными числами
Свойства действий с рациональными числами Пожелания на Новый год
Пожелания на Новый год Выполнение техники изонить во внеурочное время
Выполнение техники изонить во внеурочное время Проект: Дом будущего
Проект: Дом будущего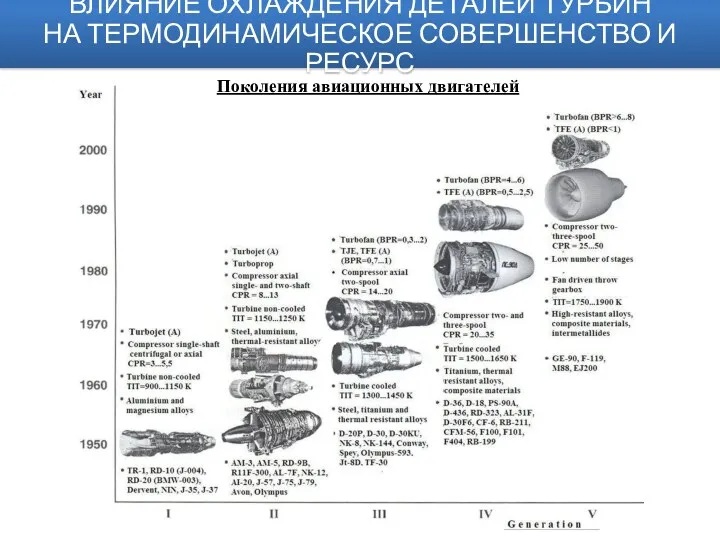 Авиационные двигатели. Влияние охлаждения деталей турбин на термодинамическое совершенство и ресурс прочности лопаток
Авиационные двигатели. Влияние охлаждения деталей турбин на термодинамическое совершенство и ресурс прочности лопаток Walt Disney
Walt Disney Авиационные ГТУ
Авиационные ГТУ Ионные уравнения
Ионные уравнения