Содержание
- 2. Д.И. Менделеев «Мощь и сила науки во множестве фактов, цель – в обобщении этого множества»
- 3. «Типы химических реакций» Тема урока:
- 4. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
- 5. Типы химических реакций Реакция разложения Реакция соединения Реакция замещения Реакция обмена
- 6. Что общего в данных реакциях? 2Н2О = 2Н2↑ + О2↑ 2KMnO4 = K2MnO4 + MnO2 +
- 7. Лабораторный опыт № 1 2Н2О2 = 2Н2О + О2 1) Данная реакция протекает в присутствии катализатора
- 8. Реакция разложения- реакция, в результате которой из одного сложного вещества образуются два или несколько простых или
- 9. Что общего в данных реакциях? 2Mg + O2 = 2MgO BaO + H2O = Ba(OH)2 Fe
- 10. 2Мg + O2 = 2MgO 1) Данная реакция сопровождается выделением тепла и света 2) Признак реакции:
- 11. Реакция соединения- реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно
- 12. Что общего в данных реакциях? Zn + 2HCl = ZnCl2 + H2↑ H2 + CuO =
- 13. Лабораторный опыт № 2 ↓ Fe + CuSO4 → FeSO4 + Cu голубой раствор Зеленый раствор
- 14. Реакция замещения- реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы
- 15. Реакция разложения
- 16. Реакция соединения
- 17. Реакция замещения
- 18. физминутка
- 19. Что общего в данных реакциях? HCl + NaOH = H2O + NaCl Ba(NO3)2 + H2SO4 =
- 20. Реакция обмена - реакция между сложными веществами, в результате которой они обмениваются своими составными частями.
- 21. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
- 22. 1 вариант 1) Al + S= Al2S3 2) Fe + HCl = FeCl2 +H2 2 вариант
- 23. 1 вариант 1) 2Al + 3S= Al2S3 Р. СОЕДИНЕНИЯ 2) Fe + 2HCl = FeCl2 +H2
- 24. самостоятельно Al + Fe2O3 = Al2O3 + Fe Na + Cl2 = NaCl CuCl2 + Al
- 25. 2Al + Fe2O3 = Al2O3 + 2Fe р.замещения 2Fe(OH)3 = Fe2O3 +3H2O р.разложения 3CuCl2 + 2Al
- 26. Рефлексия Оцените свою работу на уроке с позиции: Я научился (ась) … Я узнал (а) …
- 27. § 21 На «3» - упр.1 (по одному уравнению) На «4» -упр.1 (по 2 уравнения) На
- 29. Скачать презентацию
























 Аварийные ситуации при бурении скважин. Экономическая эффективность природоохранных мероприятий
Аварийные ситуации при бурении скважин. Экономическая эффективность природоохранных мероприятий Деление окружности на равные части. Геометрические построения – урок черчения в 8 классе
Деление окружности на равные части. Геометрические построения – урок черчения в 8 классе Правовые основы осуществления оценки воздействия намечаемой хозяйственной и иной деятельности на окружающую среду
Правовые основы осуществления оценки воздействия намечаемой хозяйственной и иной деятельности на окружающую среду Топологическое проектирование ПП
Топологическое проектирование ПП Играем пальчиками и развиваем речь
Играем пальчиками и развиваем речь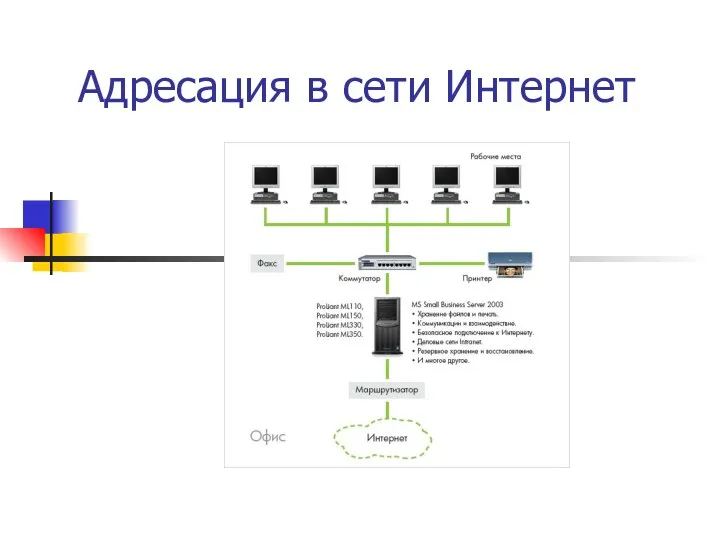 Адресация
Адресация Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Правовой режим земель запаса
Правовой режим земель запаса Конспекты, презентации к урокам,планирование.
Конспекты, презентации к урокам,планирование. Мангазея. Культура Ямала. Средние века
Мангазея. Культура Ямала. Средние века портфолио воспитателя
портфолио воспитателя Авторская система образования И.Г. Песталоцци
Авторская система образования И.Г. Песталоцци Overview of data mining
Overview of data mining Классификация схем трещин каменного здания
Классификация схем трещин каменного здания Вплив війни на психічне здоров'я 2
Вплив війни на психічне здоров'я 2 Очистка трубопровода от отложений
Очистка трубопровода от отложений Родительское собрание (презентация)
Родительское собрание (презентация) Проблема поведения в теории поля: модель личности
Проблема поведения в теории поля: модель личности Автоматический выключатель Compact NSX
Автоматический выключатель Compact NSX Классный час с презентацией Память бережно храним во 2 классе
Классный час с презентацией Память бережно храним во 2 классе Осевое вращение Земли
Осевое вращение Земли Австралия (презентация)
Австралия (презентация) Comment utiliser le subjonctif
Comment utiliser le subjonctif Презентация Методика разработки элективного курса
Презентация Методика разработки элективного курса Презентация Неделя космоса2014г.
Презентация Неделя космоса2014г. Russian cuisine
Russian cuisine Мастера живописи Саратовского края (урок по Культуре края 8 класс)
Мастера живописи Саратовского края (урок по Культуре края 8 класс) Семья в Буддизме
Семья в Буддизме