Содержание
- 2. Цели: Повторить,систематизировать и расширить знания учащихся по данной теме Развивать логическое мышление учащихся Прививать ответственность за
- 3. Положение углерода в П.С.Х.Э. Д.И.Менделеева Название элемента II период, малый. IV группа, главная подгруппа (группа А)
- 4. Строение атома углерода + 6)2)4 1s2 2s2 2р2
- 5. КРЕМНИЙ: Строение атома: 3s2р2 перескок электронов: [11] [1] [1] [1] [1] [1] [1] В природе:в организме
- 6. Аллотропные видоизменения углерода: 1-алмаз 2-графит Химические свойства углерода Что делал - Что наблюдал – Выводы. С
- 7. Оксид углерода (2),состав,строение, свойства, значение 2С +О2 =2СО (ОВР) СО2 + С =2СО(ОВР)
- 8. Физические свойства СО (2) Мr (CО) =28 Мr(возд.) =29 Д=?
- 9. 4моль _ х кДж 2СО + О2 =2СО2 +572 кДж (реши задачу: какое количество теплоты выделится
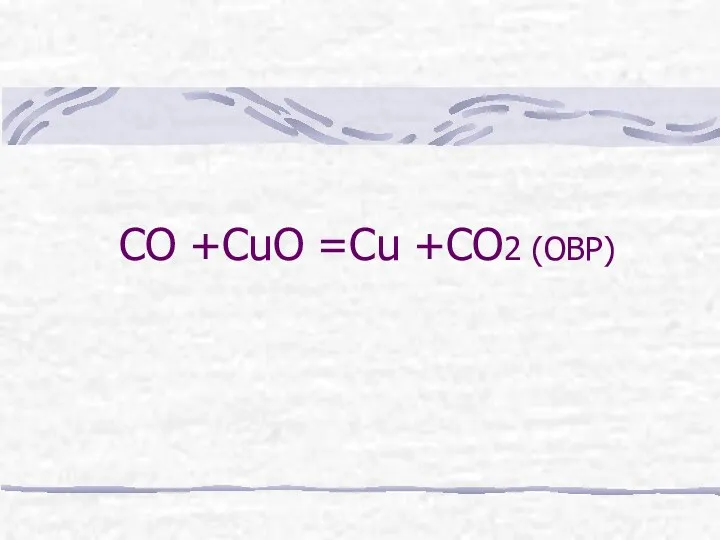
- 10. СО +СuО =Сu +СО2 (ОВР)
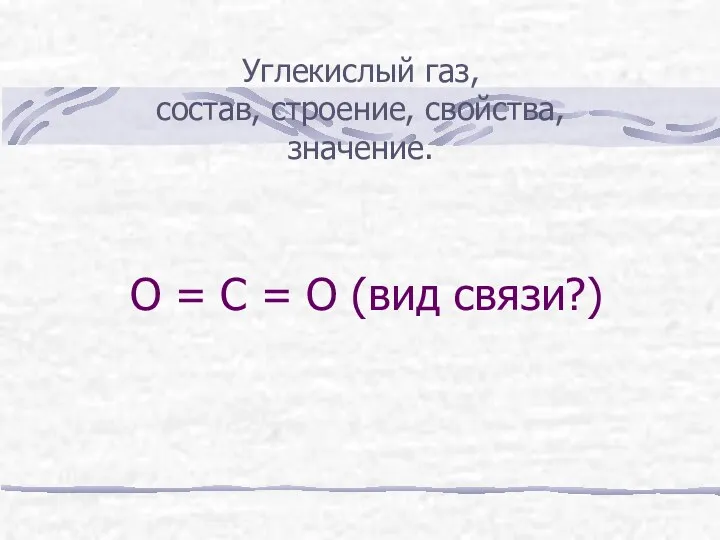
- 11. О = С = О (вид связи?) Углекислый газ, состав, строение, свойства, значение.
- 12. СО2 +Н2О =Н2СО3 (тип реакций?) СО2 + СаО =СаСО3 СО2 +2NaОН =Na2CO3 + Н2О СО2-это кислотный
- 13. Опыт: Пропускание углекислого газа через известковую воду: м= 7,4г - м= х г Са(ОН)2 + СО2
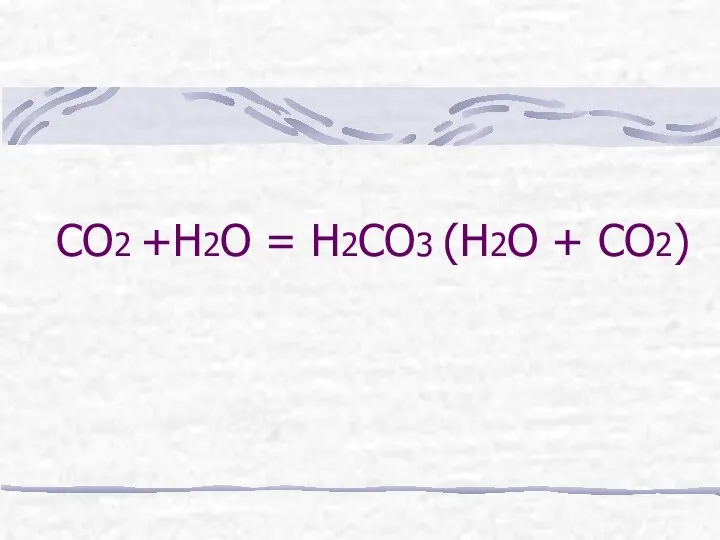
- 14. СО2 +Н2О = Н2СО3 (Н2О + СО2)
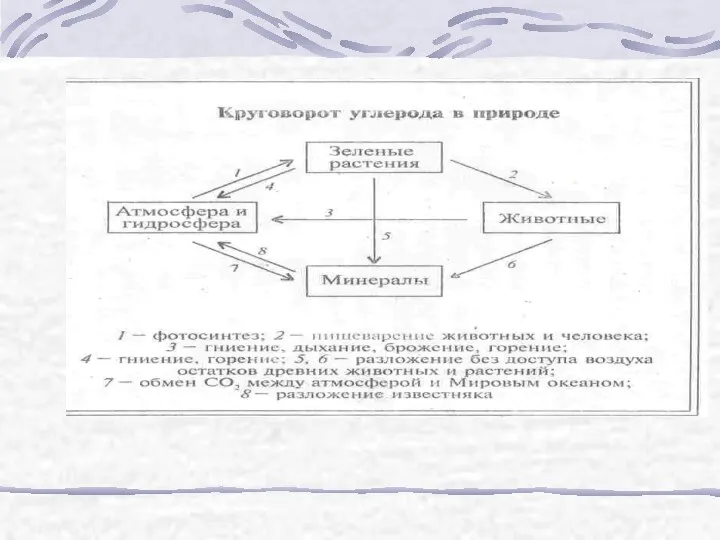
- 16. Экологические проблемы и пути их решения Сжигание угля: С +О2 =СО2 Сжигание природного газа: СН4 +2О2
- 18. Скачать презентацию



![КРЕМНИЙ: Строение атома: 3s2р2 перескок электронов: [11] [1] [1] [1]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/552723/slide-4.jpg)







 Презентация к классному часу (2 класс). Тема: Сталинград и КУбань 2 февраля - День разгрома советскими войсками немецко-фашистских войск в Сталинградской битве (1943 год)
Презентация к классному часу (2 класс). Тема: Сталинград и КУбань 2 февраля - День разгрома советскими войсками немецко-фашистских войск в Сталинградской битве (1943 год) ГК СтройГарант
ГК СтройГарант Критерии классификации правовых систем
Критерии классификации правовых систем презентация Молоко и молочные продукты
презентация Молоко и молочные продукты Контроллеры для систем вентиляции и кондиционирования
Контроллеры для систем вентиляции и кондиционирования Прием в первый класс
Прием в первый класс Neural Networks
Neural Networks Диктант Победы
Диктант Победы Первый и второй этапы сестринского процесса. Лекция 8
Первый и второй этапы сестринского процесса. Лекция 8 Создание изделий из текстильных материалов. Швейные ручные работы
Создание изделий из текстильных материалов. Швейные ручные работы Советы по созданию презентации в программе Microsoft Office PowerPoint
Советы по созданию презентации в программе Microsoft Office PowerPoint История развития гостиничной индустрии
История развития гостиничной индустрии Крепкий алкоголь
Крепкий алкоголь ЕВРАЗ: город друзей – город идей! Создание современной спортивно – игровой площадки на территории детского сада
ЕВРАЗ: город друзей – город идей! Создание современной спортивно – игровой площадки на территории детского сада Имя существительное
Имя существительное Виды мультфильмов, техники создания. Урок 1
Виды мультфильмов, техники создания. Урок 1 Комедия А.С. Грибоедова Горе от ума
Комедия А.С. Грибоедова Горе от ума Набір ювелірних каблучок Сонячний вітер
Набір ювелірних каблучок Сонячний вітер Элемент занятия по экономике
Элемент занятия по экономике Виды симметрии
Виды симметрии Изделия из соленого теста Подарок на день рождения
Изделия из соленого теста Подарок на день рождения Организация деятельности психолого-педагогического консилиума образовательной организации
Организация деятельности психолого-педагогического консилиума образовательной организации Организация речевого уголка в ДОУ
Организация речевого уголка в ДОУ Самооценка системы управления организации на базе функциональной модели оценки менеджмента
Самооценка системы управления организации на базе функциональной модели оценки менеджмента Противодействие преступлениям в сфере компьютерной информации в РФ. (Лекция 4)
Противодействие преступлениям в сфере компьютерной информации в РФ. (Лекция 4) Астенопия - синдром усталости глаза
Астенопия - синдром усталости глаза Презентация к уроку в 9 классе Химические свойства непредельных углеводородов
Презентация к уроку в 9 классе Химические свойства непредельных углеводородов Условные предложения в английском языке. Conditionals
Условные предложения в английском языке. Conditionals