Содержание
- 2. Углеводы Входят в состав клеток и тканей всех растительных и животных организмов. По массе составляют основную
- 3. Углеводы Источники энергии в метаболических процессах (крахмал, гликоген) Структурные компоненты клеточных стенок (целлюлоза, хитин и др.)
- 4. Образуются в растениях в процессе фотосинтеза из диоксида углерода и воды. Животные организмы не способны синтезировать
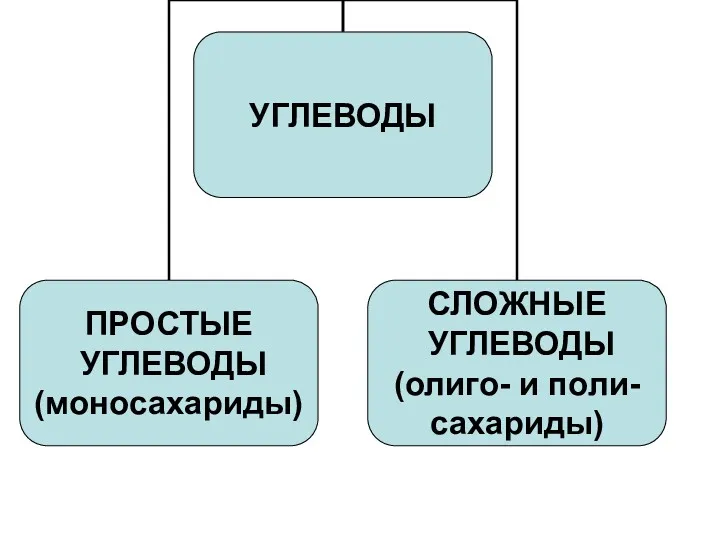
- 5. Класс углеводов (сахаров, карбогидратов) объединяет соединения, имеющие состав СnH2nOn и обладающие при этом весьма разнообразными свойствами.
- 7. По способности к гидролизу: - Моносахариды (простые сахара, монозы) не гидролизуются с образованием более простых углеводов.
- 8. Моносахариды Гетерофункциональные соединения, содержат одновременно карбонильную и несколько гидроксильных групп: - полигидроксиальдегиды (альдозы) - полигидроксикетоны (кетозы)
- 9. Все моносахариды представляют собой кристаллические вещества, хорошо растворимые в воде и обладающие, как правило, сладким вкусом.
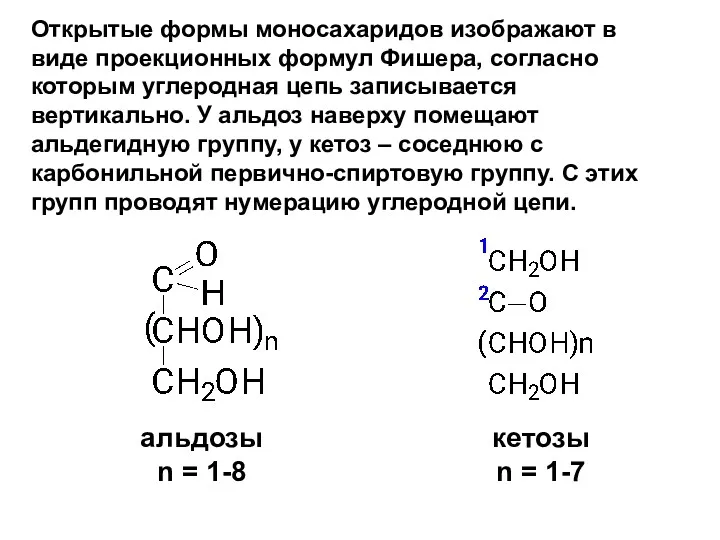
- 10. Открытые формы моносахаридов изображают в виде проекционных формул Фишера, согласно которым углеродная цепь записывается вертикально. У
- 11. В зависимости от длины углеродной цепи (3 – 10 атомов): - триозы - тетрозы - пентозы
- 12. Наличие в молекулах моносахаридов нескольких центров хиральности – причина существования большого числа стереоизомеров, соответствующих одной и
- 13. Альдогексоза HOCH2(*CHOH)4CHO число стереоизомеров = 24 = 16 (8 пар энантиомеров) В биологических средах преимущественно распространены
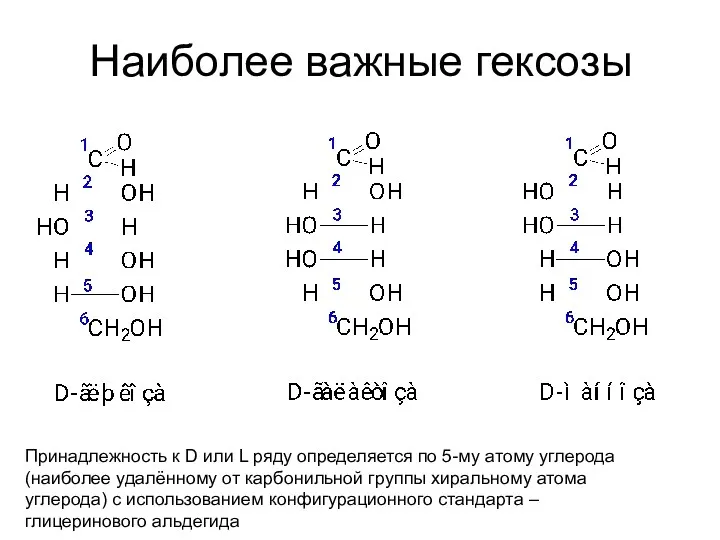
- 14. Наиболее важные гексозы Принадлежность к D или L ряду определяется по 5-му атому углерода (наиболее удалённому
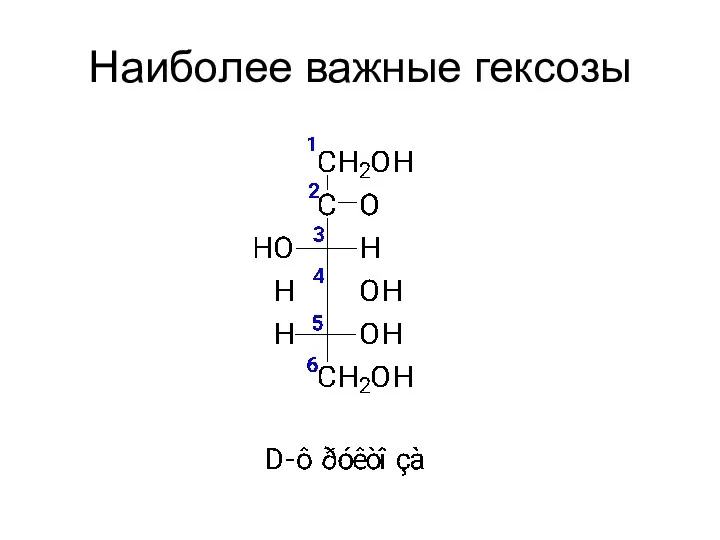
- 15. Наиболее важные гексозы
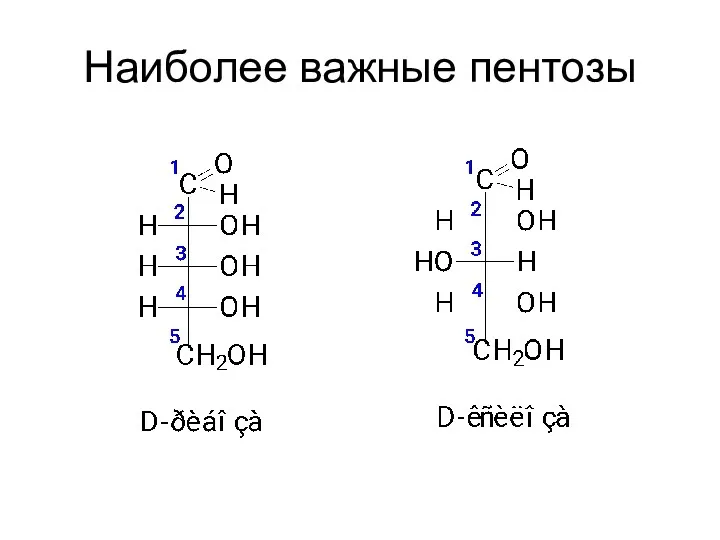
- 16. Наиболее важные пентозы
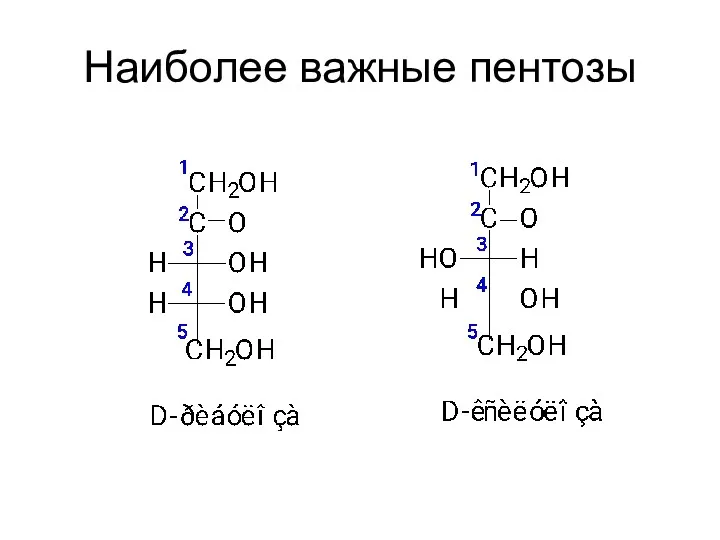
- 17. Наиболее важные пентозы
- 18. Циклические формы - по химической природе являются циклическими полуацеталями. Моносахариды за счет внутримолекулярного взаимодействия сближенных в
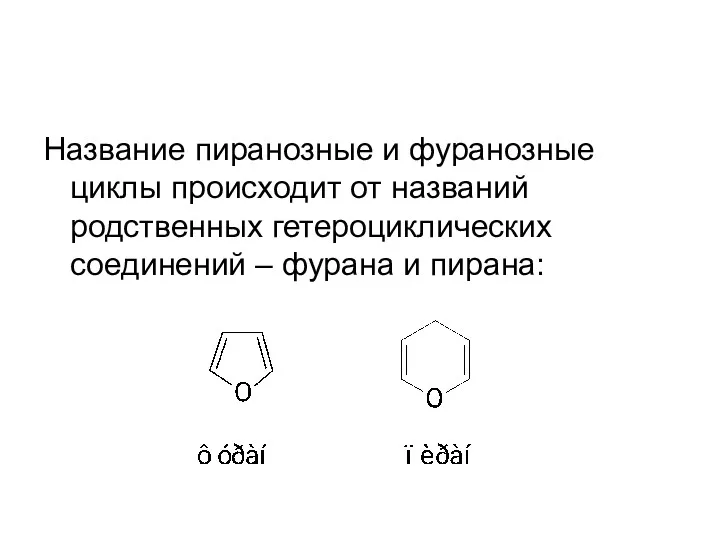
- 19. Название пиранозные и фуранозные циклы происходит от названий родственных гетероциклических соединений – фурана и пирана:
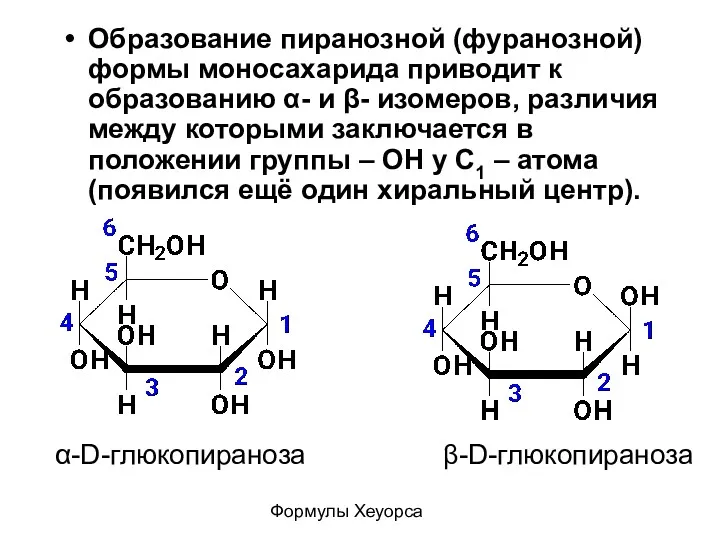
- 20. Образование пиранозной (фуранозной) формы моносахарида приводит к образованию α- и β- изомеров, различия между которыми заключается
- 21. Появившаяся дополнительная гидроксильная группа, связанная с С1 – атомом, называется гликозидной (полуацетальной). По свойствам она значительно
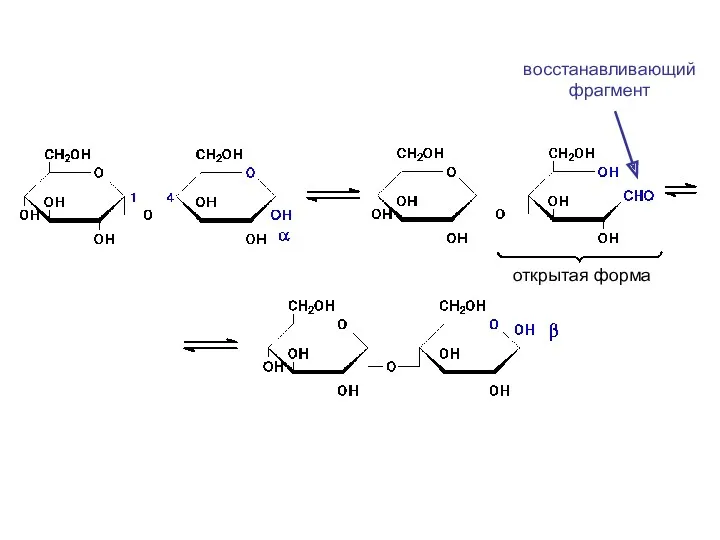
- 22. В растворах сахаров при стоянии наблюдается изменение угла отклонения плоскости поляризованного света, т.е. изменение оптической активности
- 23. ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ I. Химические реакции с участием гидроксильных групп. I.1. Полуацетальный гидроксил непрочно связан с
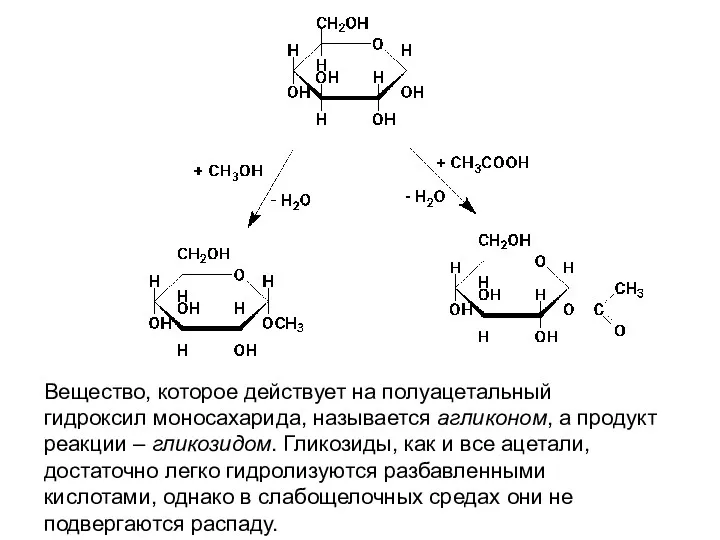
- 24. Вещество, которое действует на полуацетальный гидроксил моносахарида, называется агликоном, а продукт реакции – гликозидом. Гликозиды, как
- 25. I.2. При определённых условиях в реакцию вступает не только полуацетальный гидроксил, но и имеющиеся в молекуле
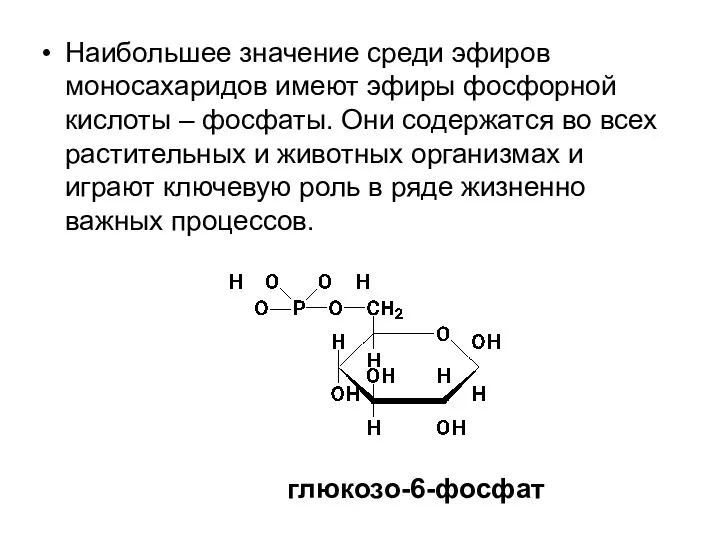
- 26. Наибольшее значение среди эфиров моносахаридов имеют эфиры фосфорной кислоты – фосфаты. Они содержатся во всех растительных
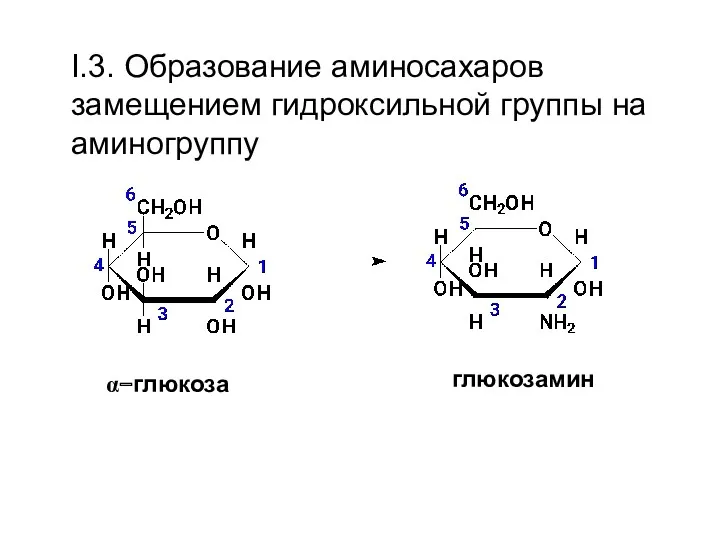
- 27. I.3. Образование аминосахаров замещением гидроксильной группы на аминогруппу α−глюкоза глюкозамин
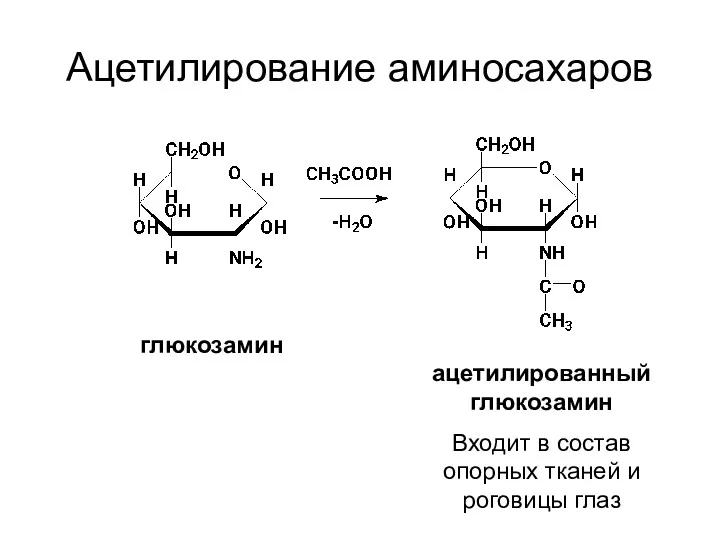
- 28. Ацетилирование аминосахаров глюкозамин ацетилированный глюкозамин Входит в состав опорных тканей и роговицы глаз
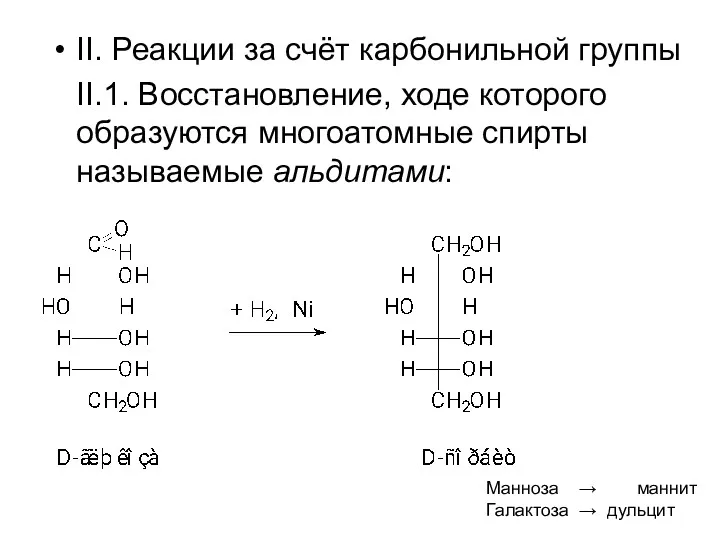
- 29. II. Реакции за счёт карбонильной группы II.1. Восстановление, ходе которого образуются многоатомные спирты называемые альдитами: Манноза
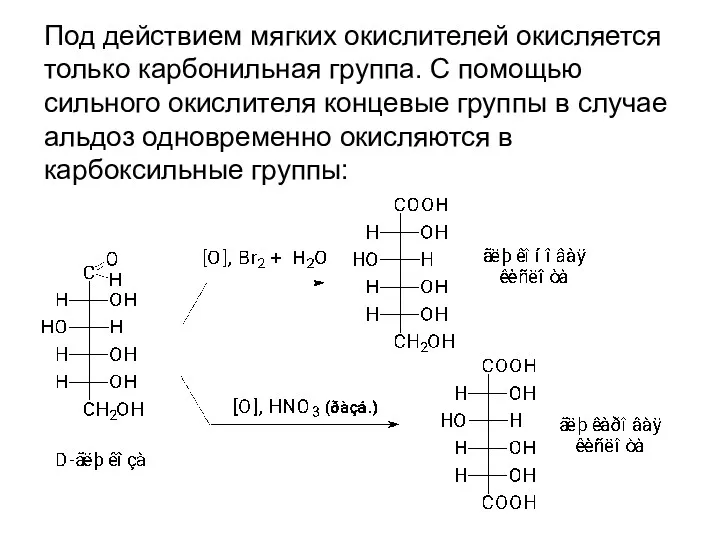
- 30. II.2. Окисление - важная реакция в химии углеводов. Его используют для получения ряда соединений в структурных
- 31. Под действием мягких окислителей окисляется только карбонильная группа. С помощью сильного окислителя концевые группы в случае
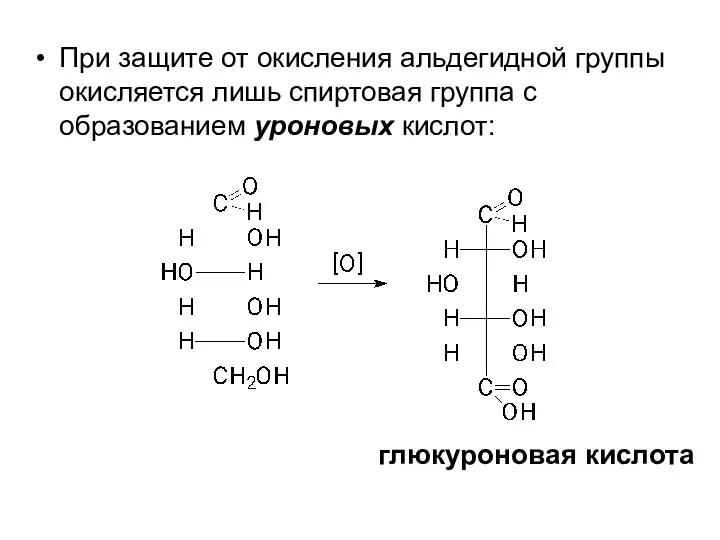
- 32. При защите от окисления альдегидной группы окисляется лишь спиртовая группа с образованием уроновых кислот: глюкуроновая кислота
- 33. СЛОЖНЫЕ УГЛЕВОДЫ
- 34. Олигосахариды классифицируют: в зависимости от числа моносахаридных фрагментов, входящих в олигосахарид (дисахариды, трисахариды, тетрасахариды и т.
- 35. Из олигосахаридов в природе наиболее широко распространены дисахариды. Дисахариды - О-гликозиды (полные ацетали) С гликозидной природой
- 36. У восстанавливающих дисахаридов связь между моносахаридными остатками осуществляется за счет спиртового и полуацетального гидроксилов. При этом
- 37. У невосстанавливающих дисахаридов гликозидная связь образована за счет полуацетальных гидроксилов обоих моносахаридов. Они не содержат свободного
- 38. Представители восстанавливающих дисахаридов: - мальтоза, - целлобиоза, - лактоза
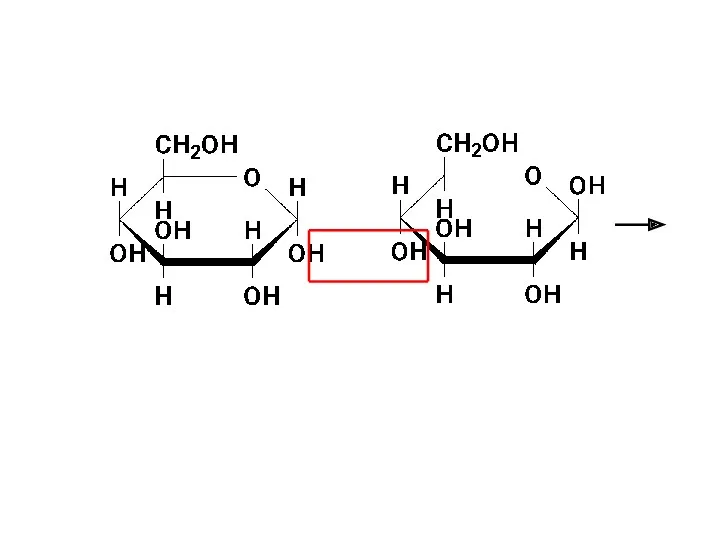
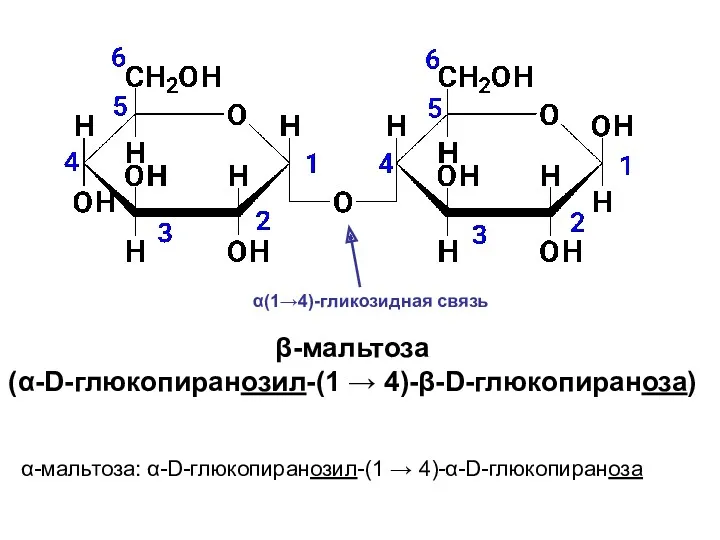
- 39. Мальтоза (солодовый сахар) является основным продуктом расщепления крахмала под действием фермента β-амилазы, выделяемого слюнной железой. В
- 41. β-мальтоза (α-D-глюкопиранозил-(1 → 4)-β-D-глюкопираноза) α-мальтоза: α-D-глюкопиранозил-(1 → 4)-α-D-глюкопираноза α(1→4)-гликозидная связь
- 42. восстанавливающий фрагмент открытая форма
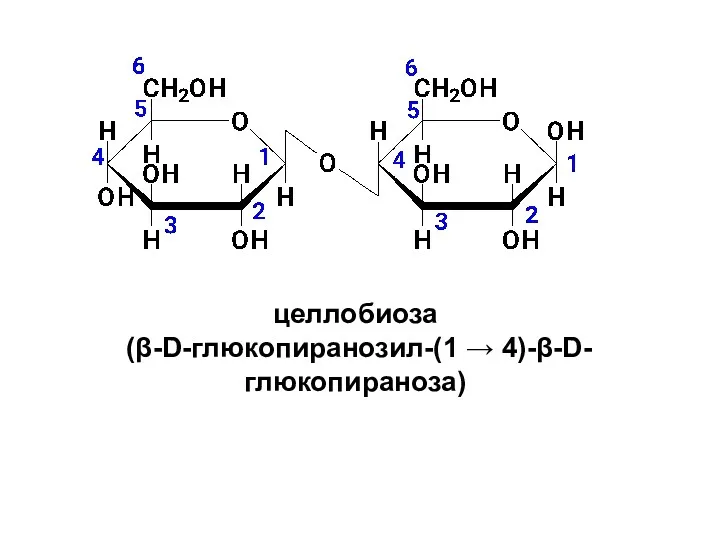
- 43. Целлобиоза образуется при неполном гидролизе полисахарида целлюлозы. Она также построена из двух молекул глюкозы, но отличается
- 44. целлобиоза (β-D-глюкопиранозил-(1 → 4)-β-D-глюкопираноза)
- 45. мальтоза расщепляется в организме человека ферментом α-глюкозидазой (мальтазой) целлобиоза расщепляется ферментом β-глюкозидазой, который в организме человека
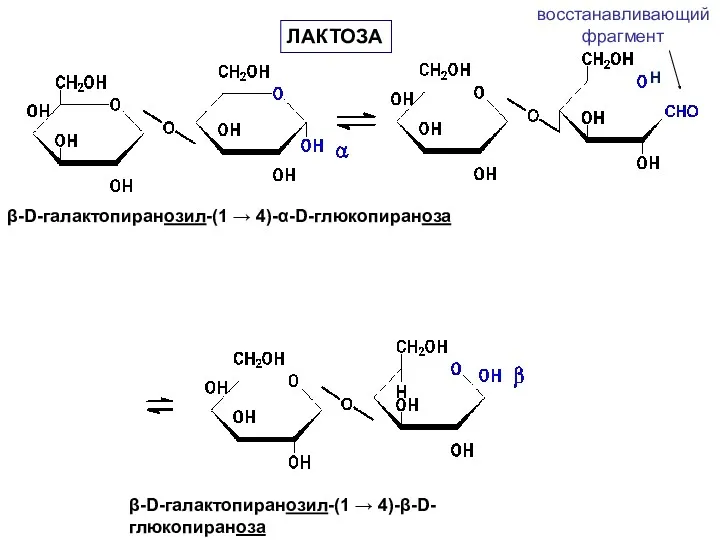
- 46. Лактоза содержится в молоке (4-5%), получают из молочной сыворотки (молочный сахар). Лактоза построена из остатков D-галактопиранозы
- 47. β-D-галактопиранозил-(1 → 4)-α-D-глюкопираноза β-D-галактопиранозил-(1 → 4)-β-D-глюкопираноза восстанавливающий фрагмент ЛАКТОЗА H
- 48. Лактоза применяется - в фармацевтике при изготовлении порошков и таблеток (менее гигроскопична, чем сахар) - питательное
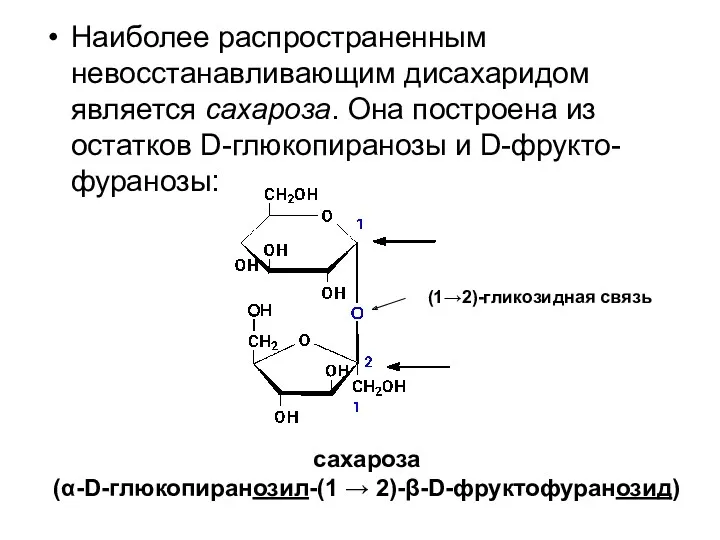
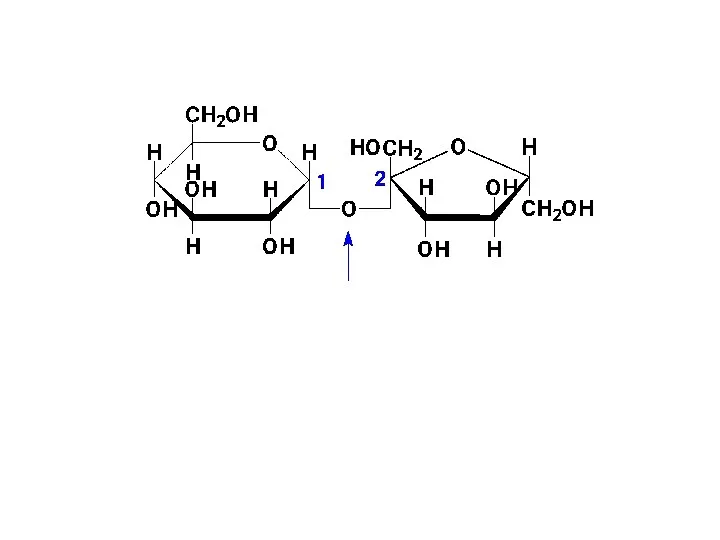
- 49. Наиболее распространенным невосстанавливающим дисахаридом является сахароза. Она построена из остатков D-глюкопиранозы и D-фрукто-фуранозы: сахароза (α-D-глюкопиранозил-(1 →
- 51. Химические свойства дисахаридов I. ВСЕ: 1) подвергаются гидролизу (под действием ферментов, в кислой среде) 2) образуют
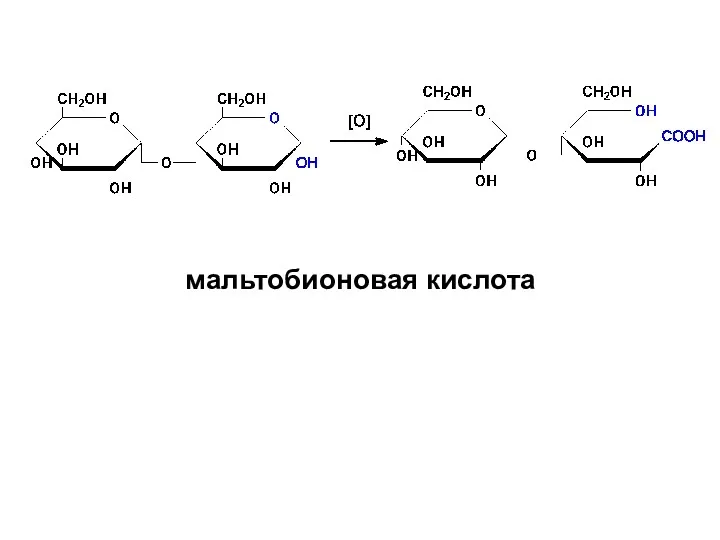
- 52. II. Только ВОССТАНАВЛИВАЮЩИЕ: 1) обладают мутаротацией 2) проявляют восстановительные свойства: а) окисляются в гликобионовые кислоты
- 53. мальтобионовая кислота
- 54. NB! Пробы Троммера, Фелинга и др. 3) реакции альдегидной группы
- 55. В отличие от большинства дисахаридов сахароза не имеет свободного полуацетального гидроксила и, как следствие, не обладает
- 56. Полисахариды Полисахариды представляют собой продукты поликонденсации моносахаридов, которые связаны друг с другом гликозидными связями. Таким образом,
- 57. Гликозидная природа полисахаридов обусловливает их способность к гидролизу в кислой среде. Полный гидролиз приводит к образованию
- 58. Крахмал (резервный гомополисахарид растений) представляет собой белое аморфное вещество, нерастворимое в холодной воде. При быстром нагревании
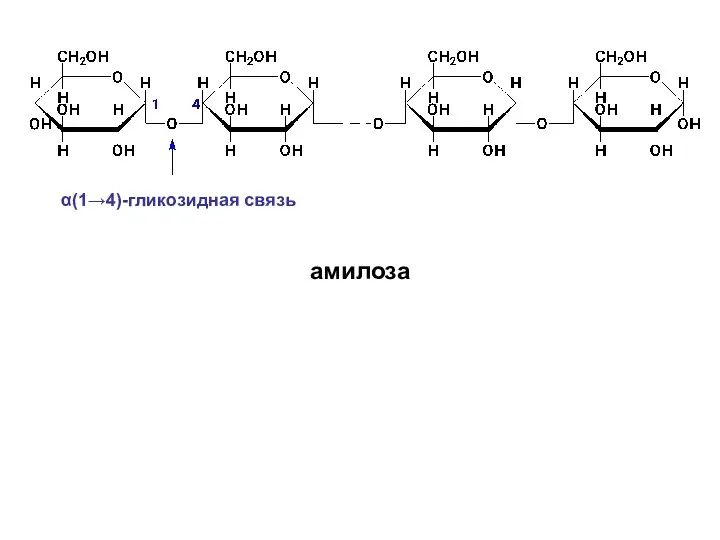
- 59. В амилозе D-глюкопиранозные остатки связаны α-(1→4)-гликозидными связями, т.е. дисахаридным фрагментом амилозы является мальтоза. Цепь амилозы неразветвленная.
- 60. α(1→4)-гликозидная связь амилоза
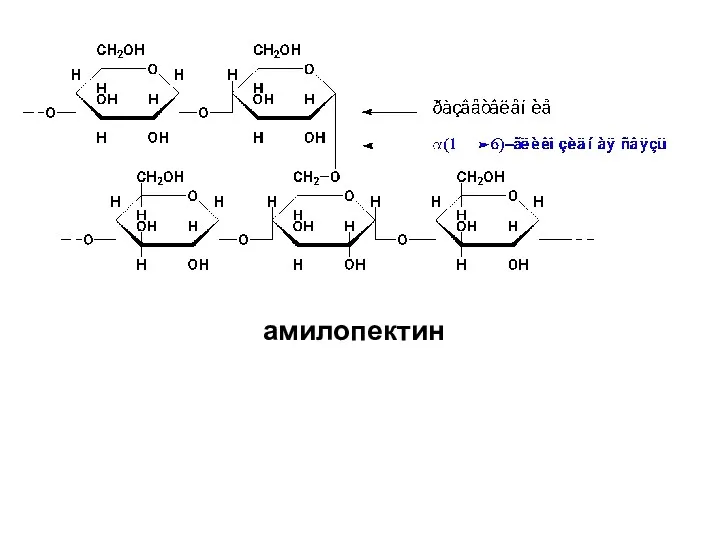
- 61. Амилопектин отличается от амилозы высокоразветвленным строением. В линейных участках этого полисахарида D-глюкопиранозные остатки связаны α-(1→4)-гликозидными связями,
- 62. амилопектин
- 63. Гликоген (резевный гомополисахарид животных организмов) является структурным и функциональным аналогом крахмала. По строению подобен амилопектину, но
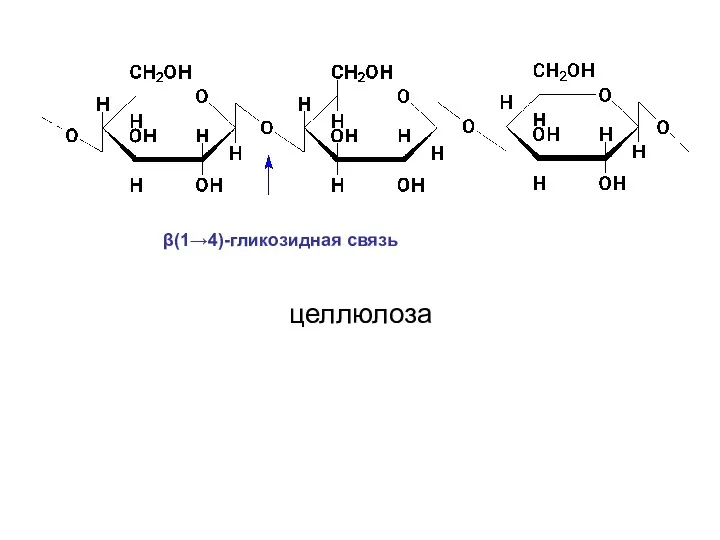
- 64. Целлюлоза или клетчатка представляет собой наиболее распространенный структурный гомополисахарид растений. Она состоит из остатков D-глюкопиранозы, которые
- 65. Макромолекула целлюлозы имеет строго линейное строение. Благодаря этому внутри цепи, а также между соседними цепями образуются
- 66. β(1→4)-гликозидная связь целлюлоза
- 68. Скачать презентацию







































 Анна Павлова (1881–1931 гг.)
Анна Павлова (1881–1931 гг.) Презентация Лесные жители
Презентация Лесные жители Первые паровозы
Первые паровозы Деформации и разрушения дорожных одежд
Деформации и разрушения дорожных одежд Презентация к родительскому собранию Конфликты в младшем школьном возрасте. Как их избежать
Презентация к родительскому собранию Конфликты в младшем школьном возрасте. Как их избежать Программа для работы с графами (grin). Дискретная математика
Программа для работы с графами (grin). Дискретная математика Служебные преступления главы 23 и 30 УК РФ
Служебные преступления главы 23 и 30 УК РФ Социальная психология образования. Магистерская программа
Социальная психология образования. Магистерская программа Квалиметрия в социальной работе
Квалиметрия в социальной работе Знакомство с плодами зерновых культур2
Знакомство с плодами зерновых культур2 Культура Бразилії
Культура Бразилії Религиозная организация христиан еры евангельской (пятидесятников). Ярославская церковь Победа Христа
Религиозная организация христиан еры евангельской (пятидесятников). Ярославская церковь Победа Христа Медициналық қызмет сапасын жақсарту бойынша денсаулық сақтау стратегиялық жоспары
Медициналық қызмет сапасын жақсарту бойынша денсаулық сақтау стратегиялық жоспары Мясо птицы
Мясо птицы 20231112_igra_8_klass_novoe_vremya
20231112_igra_8_klass_novoe_vremya электронный портфолио воспитателя ДОУ
электронный портфолио воспитателя ДОУ Атлантический океан. Основные характеристики Атлантического океана
Атлантический океан. Основные характеристики Атлантического океана Freelace holder installation guideline (1)
Freelace holder installation guideline (1) Принцип роботи ядерних електростанцій
Принцип роботи ядерних електростанцій Дыхательная гимнастика
Дыхательная гимнастика Организация проектной деятельности в школе
Организация проектной деятельности в школе Схема расположения ПР и ШР на участке 1.3
Схема расположения ПР и ШР на участке 1.3 Организация контроля качества в гражданской авиации. Контроль качества авиаГСМ при приеме на склад
Организация контроля качества в гражданской авиации. Контроль качества авиаГСМ при приеме на склад Моніторинг і коментарі до нормативно-правових актів у сфері оподаткування, жовтень 2016
Моніторинг і коментарі до нормативно-правових актів у сфері оподаткування, жовтень 2016 Комитет по строительству, архитектуре и развитию города Барнаула
Комитет по строительству, архитектуре и развитию города Барнаула Экология 4А Баева
Экология 4А Баева Производство серной кислоты
Производство серной кислоты Подлежащее и сказуемое - главные члены предложения
Подлежащее и сказуемое - главные члены предложения