Содержание
- 2. ГЕСС, ГЕРМАН ИВАНОВИЧ Родился 26 июля (7 августа) 1802 в Женеве. Вместе с семьей переехал в
- 3. Закон Гесса (1840 г): Тепловой эффект химической реакции зависит только от начального и конечного состояния веществ
- 4. 1 следствие тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом сумм теплот образования
- 5. 2 следствие (для горючих веществ): тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за
- 6. 3 следствие: Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом
- 7. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при
- 8. закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их,
- 9. Например Диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через
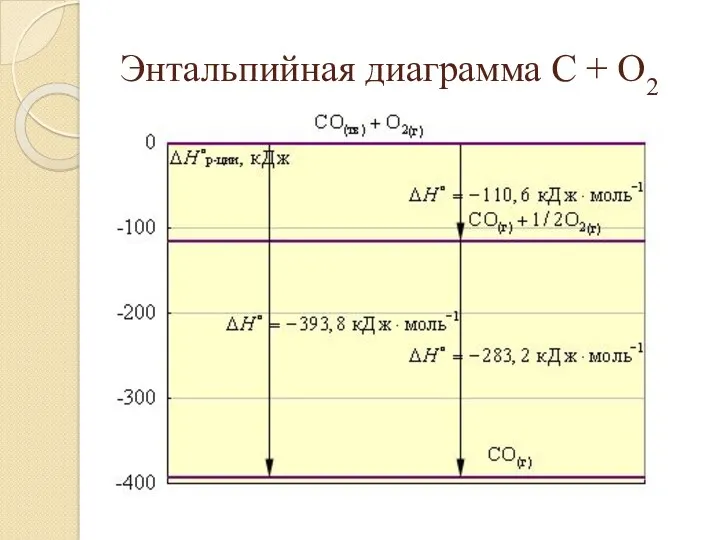
- 10. Энтальпийная диаграмма C + O2
- 11. ЗАДАЧА 1. Рассчитайте тепловой эффект реакции: 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж), если ΔH0обр NH3(г)
- 12. ЗАДАЧА 2. Определить тепловой эффект реакции гидролиза нитрида магния Mg3N2(тв.)+6H2O(ж.)=3Mg(OH)2(тв.)+ NH3(г.). Решение H = Hобр.прод. –
- 13. ЗАДАЧА 3. Вычислить стандартную энтальпию реакции: 2C2H5OH(жидк.)C2H5OC2H5(жидк.) 2O(жидк.) по значениям стандартных энтальпий сгорания веществ: H0сгор. C2H5OH
- 15. Скачать презентацию











 Клеточный цикл
Клеточный цикл 20231016_master_klass
20231016_master_klass Фонтаны. Работа с пластичными материалами. Конструирование
Фонтаны. Работа с пластичными материалами. Конструирование Смешарики
Смешарики Профессия повар, кондитер
Профессия повар, кондитер С днем учителя
С днем учителя Winemaking in South Africa
Winemaking in South Africa Санитарные требования к проведению уборки. Выбор моющих средств
Санитарные требования к проведению уборки. Выбор моющих средств Sensory testing of food products
Sensory testing of food products Как стать здоровым и успешным. Памятка школьнику.
Как стать здоровым и успешным. Памятка школьнику. Пластилинография
Пластилинография Проводники в электростатическом поле. Тема 5
Проводники в электростатическом поле. Тема 5 Место предмета Естествознание в курсе средней школы. Мнения: за и против
Место предмета Естествознание в курсе средней школы. Мнения: за и против Business Start presentation 2022-05-16 N21
Business Start presentation 2022-05-16 N21 Выпускной в начальной школе
Выпускной в начальной школе Производственная практика на АО Алмазы Анабара. Промывка геологических проб
Производственная практика на АО Алмазы Анабара. Промывка геологических проб Человек и домашние животные
Человек и домашние животные Презентация к беседе о здоровом образе жизни Рациональное питание
Презентация к беседе о здоровом образе жизни Рациональное питание История развития детского движения. Уроки прошлого
История развития детского движения. Уроки прошлого сопряжение
сопряжение Traumatic shock
Traumatic shock Nagłe przypadki w praktyce lekarza rodzinnego
Nagłe przypadki w praktyce lekarza rodzinnego Диагностика представлений дошкольников о безопасной жизнедеятельности.
Диагностика представлений дошкольников о безопасной жизнедеятельности. Ікона Матері Божої помічниці переслідуваних християн
Ікона Матері Божої помічниці переслідуваних християн Разработка конструкции стенда для термовакуумной обработки изделий
Разработка конструкции стенда для термовакуумной обработки изделий Обобщающий урок по теме Африка. География. 7 класс
Обобщающий урок по теме Африка. География. 7 класс Презентация В ЗДОРОВОМ ТЕЛЕ - ЗДОРОВЫЙ ДУХ! (Старшая группа).
Презентация В ЗДОРОВОМ ТЕЛЕ - ЗДОРОВЫЙ ДУХ! (Старшая группа). Расчет параметров и выбор оборудования для транспортировки реактивного топлива
Расчет параметров и выбор оборудования для транспортировки реактивного топлива