Содержание
- 2. На уроке мы сможем: Узнать: строение молекулы аммиака и иона аммония; механизм образования связи по донорно-акцепторному
- 3. NH3 Эта история произошла во время I мировой войны.
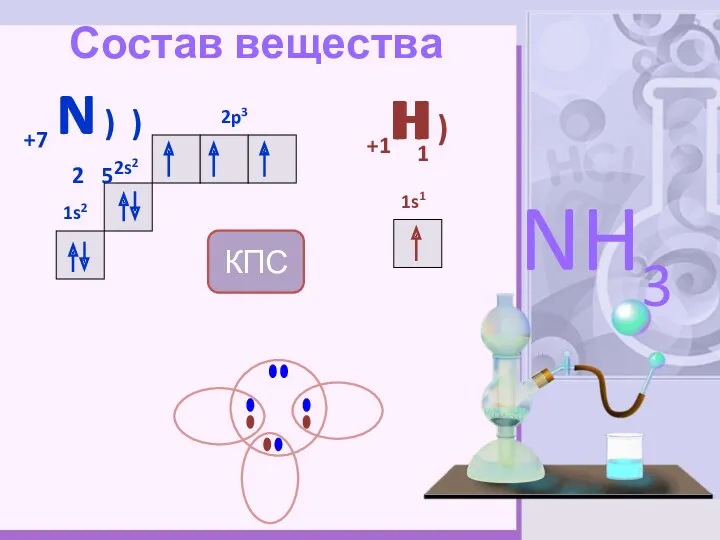
- 4. Состав вещества +7 N ) ) 2 5 2s2 1s2 2p3 +1H ) 1s1 NH3 H
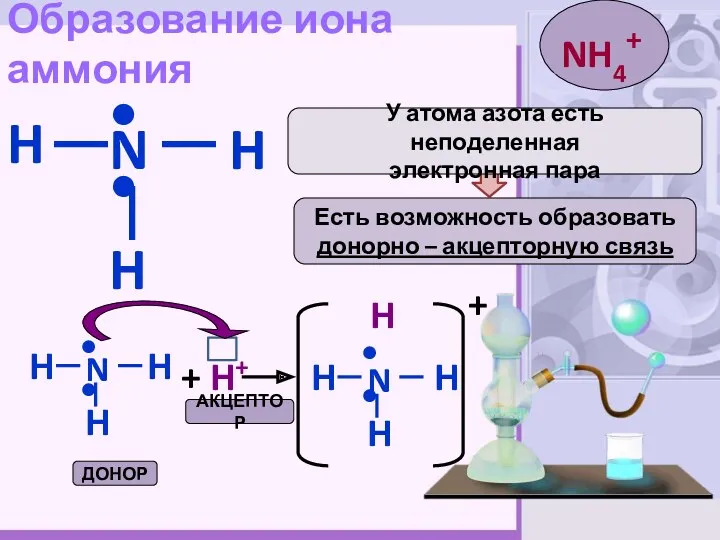
- 5. Образование иона аммония H N H H •• Есть возможность образовать донорно – акцепторную связь У
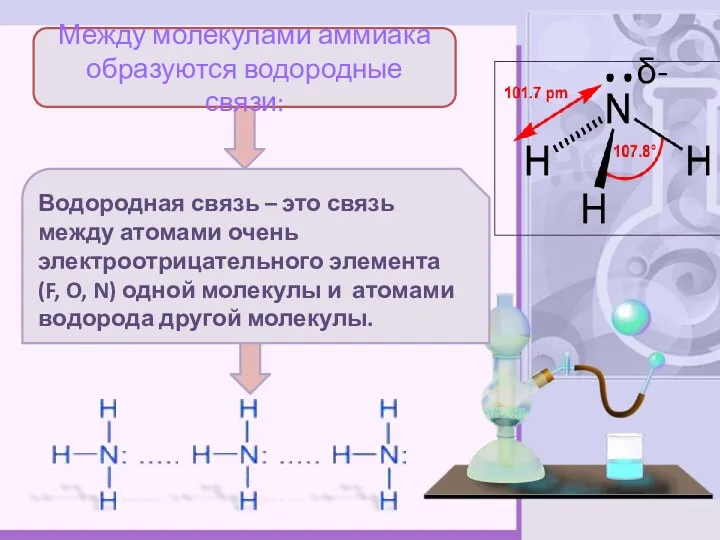
- 6. Между молекулами аммиака образуются водородные связи: Водородная связь – это связь между атомами очень электроотрицательного элемента
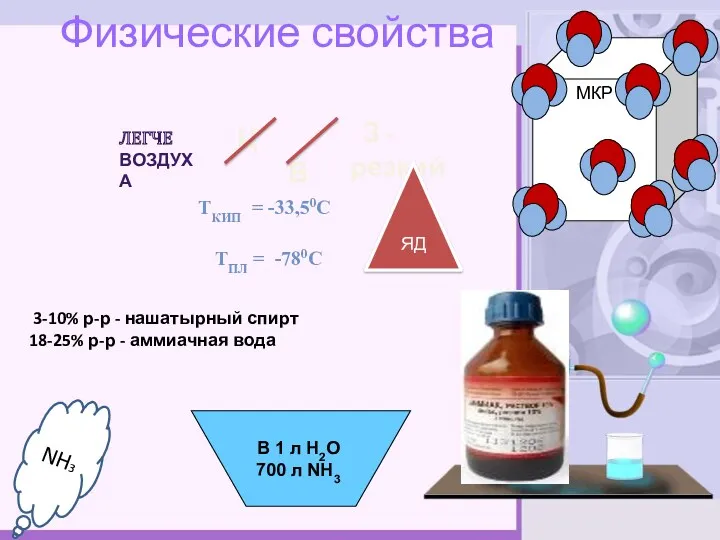
- 7. Ц Физические свойства Ткип = -33,50С Тпл = -780С 3-10% р-р - нашатырный спирт 18-25% р-р
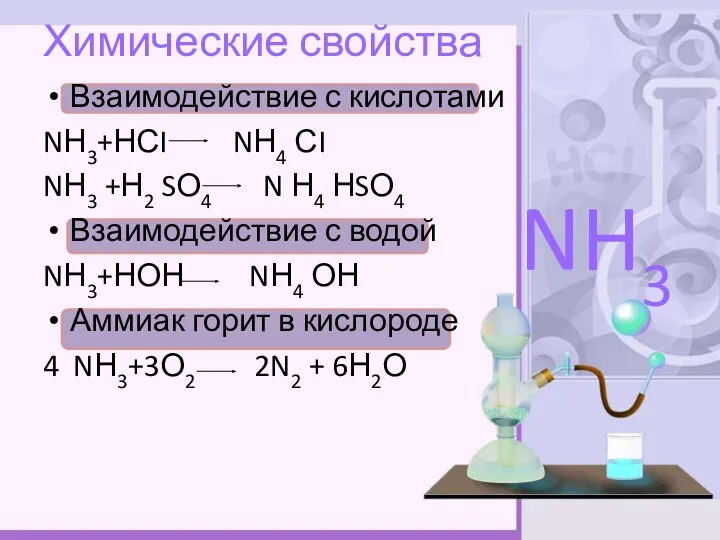
- 8. Химические свойства Взаимодействие с кислотами NН3+НСI NН4 СI NН3 +Н2 SО4 N Н4 НSО4 Взаимодействие с
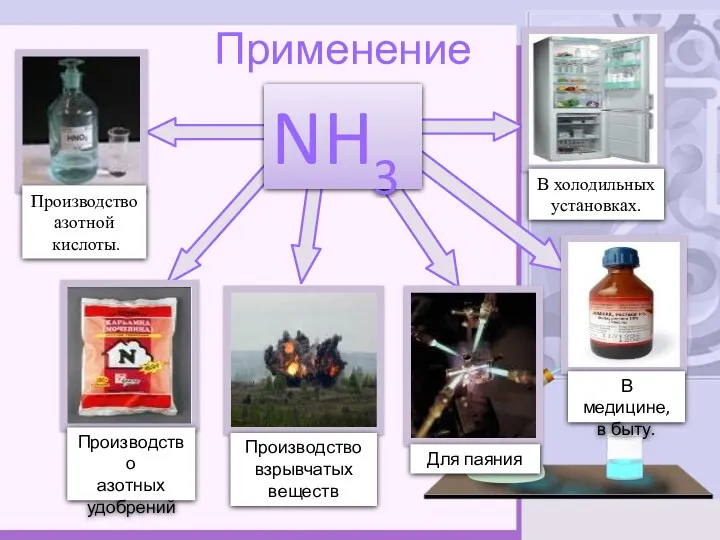
- 9. Применение NH3 Производство азотной кислоты. Производство азотных удобрений Производство взрывчатых веществ В холодильных установках. В медицине,
- 10. Проверка знаний. Решите задачи: При синтезе аммиака промышленным способом, азот объёмом 50 л. (н.у.) прореагировал с
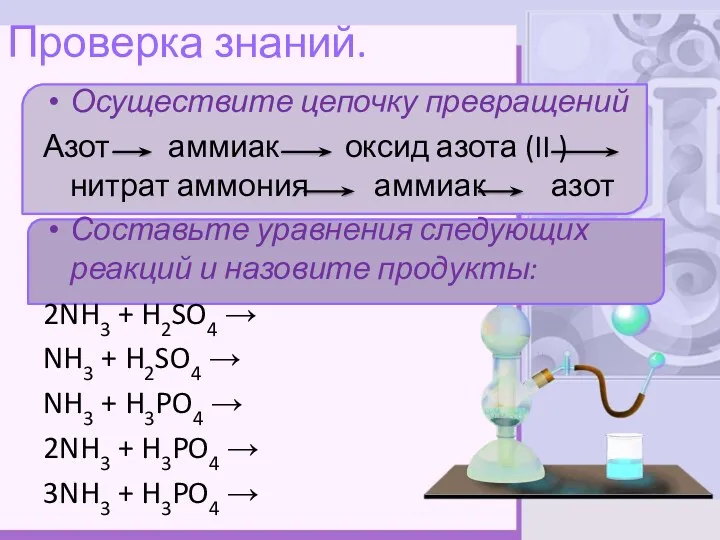
- 11. Проверка знаний. Осуществите цепочку превращений Азот аммиак оксид азота (II ) нитрат аммония аммиак азот Составьте
- 12. Домашнее задание: §25,упр. 1-5. Получение аммиака выучить самостоятельно.
- 14. Скачать презентацию




 Социальная структура общества
Социальная структура общества Техническое обслуживание магистральных газопроводов
Техническое обслуживание магистральных газопроводов Презентация к уроку технологии:Поделка в подарок папе к 23 февраля.
Презентация к уроку технологии:Поделка в подарок папе к 23 февраля. Розвиток освіти і педагогічної думки в епоху українського відродження
Розвиток освіти і педагогічної думки в епоху українського відродження Жатыр мойнының ісік алды және фондық аурулары
Жатыр мойнының ісік алды және фондық аурулары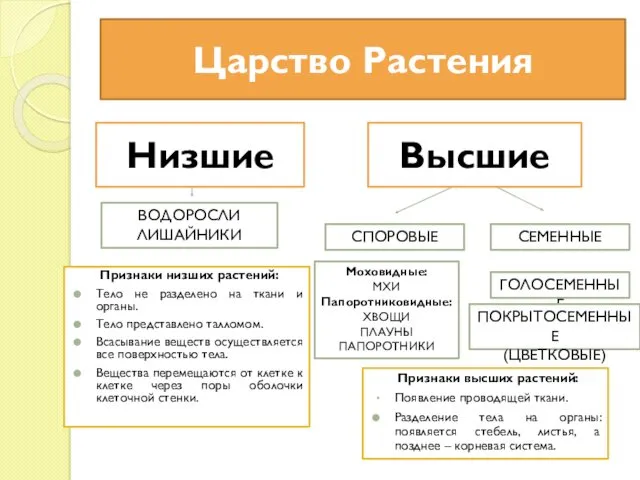 Царство Растения. Низшие Водоросли Лишайники
Царство Растения. Низшие Водоросли Лишайники Презентация Театрализованная деятельность как средство всестороннего развития детей в условиях ДОУ
Презентация Театрализованная деятельность как средство всестороннего развития детей в условиях ДОУ Движение Луны. Затмения
Движение Луны. Затмения Moral Philosophy. Normative Ethics
Moral Philosophy. Normative Ethics Молочный цех для переработки молока в условиях ТОО Отес- Акдала
Молочный цех для переработки молока в условиях ТОО Отес- Акдала Презентация на тему Здоровое питание
Презентация на тему Здоровое питание Образование Союза Советских Социалистических Республик
Образование Союза Советских Социалистических Республик Морской бой. Викторина
Морской бой. Викторина Философия, как форма духовной культуры и гносеология. (Лекция 1)
Философия, как форма духовной культуры и гносеология. (Лекция 1) Пезентация пректа Наши умные пальчики
Пезентация пректа Наши умные пальчики Конденсаторы. Виды Конденсаторов
Конденсаторы. Виды Конденсаторов Жартылай өткізгіштік қуралдар
Жартылай өткізгіштік қуралдар Презентация Классификация химических реакций
Презентация Классификация химических реакций Правовое регулирование профессиональной медицинской деятельности
Правовое регулирование профессиональной медицинской деятельности Многокритериальный анализ решений. Структурирование многокритериальной задачи, деревья критериев. Парето-оптимальные решения
Многокритериальный анализ решений. Структурирование многокритериальной задачи, деревья критериев. Парето-оптимальные решения Экологические поселения
Экологические поселения Дизайн. Основные понятия и определения. Специфика дизайн-проектирования
Дизайн. Основные понятия и определения. Специфика дизайн-проектирования Цепи однофазного переменного синусоидального тока
Цепи однофазного переменного синусоидального тока Геодезические изыскания при проведении реконструкции линейного объекта
Геодезические изыскания при проведении реконструкции линейного объекта Климатические условия Подмосковья
Климатические условия Подмосковья Колониальная политика европейских государств и США
Колониальная политика европейских государств и США Портфолио воспитателя
Портфолио воспитателя Адаптированная общеобразовательная программа для ребёнка с ОВЗ Иванова Сергея 6 лет подготовительной группы МБДОУ Комаричский д-с №3
Адаптированная общеобразовательная программа для ребёнка с ОВЗ Иванова Сергея 6 лет подготовительной группы МБДОУ Комаричский д-с №3