Содержание
- 2. Обобщить и закрепить знания о сущности процессов окисления и восстановления; окислительно-восстановительных реакциях. Актуализировать знания и умения
- 3. Степень окисления у свободных атомов и у атомов с ковалентной неполярной связью равно нулю. О20 ;
- 4. Пример 1: Определить степени окисления элементов в оксиде натрия Na2O. Степень окисления кислорода равна 6 –
- 5. Вопросы для повторения: Какие реакции называются окислительно-восстановительными? Что такое окисление? Какой процесс называют восстановлением? Как называются
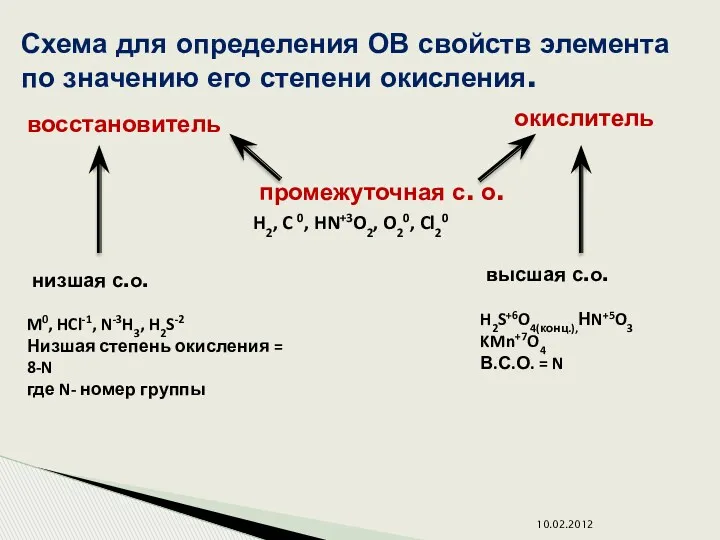
- 6. Схема для определения ОВ свойств элемента по значению его степени окисления. восстановитель окислитель промежуточная с. о.
- 7. Определите степень окисления элементов в следующих соединениях: КСIO3, НСIO4, Са(НСО3)2 , О2 , (NH4)2Cr2O7, NaNO2, H2SeO3,
- 8. Hg+ S = HgS NaNO3 = NaNO2 + O2 CuCl2 + NaOH = NaCl+ Cu(OH)2 Укажите
- 9. Al(OH)3 = Al2O3 + H2O H2O + P2O5 = H3PO4 Mg + HCl = MgCl2 +
- 10. 1) Во всех ли случаях происходит изменение степеней окисления химических элементов? 2) Зависит ли это от
- 11. Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ . Реакции, при которых
- 12. Расставить степени окисления всех элементов. Выбрать элементы, изменившие степень окисления. Выписать эти элементы и показать схематично
- 13. KMn +7 O4 + HCl-1→ Mn +2Cl2 + KCl + Cl20 + H2O Пример. Mn+7 +5e
- 14. Расставить коэффициенты методом электронного баланса: NH3 + SO2 → N2 + S + H2O Cl2+ KOH
- 16. Скачать презентацию












 Написание сочинения-рассуждения
Написание сочинения-рассуждения IVoice. Интеллектуальный голосовой помощник для вашего бизнеса
IVoice. Интеллектуальный голосовой помощник для вашего бизнеса Презентация к сценарию праздника Прощай, Букварь.
Презентация к сценарию праздника Прощай, Букварь. Проектирование блочной котельной для гостиницы
Проектирование блочной котельной для гостиницы Путешествие в страну Морфемика. (5 класс)
Путешествие в страну Морфемика. (5 класс) Ислам. Догматика ислама
Ислам. Догматика ислама Применение подобия треугольников в жизни. Измерительные работы на местности
Применение подобия треугольников в жизни. Измерительные работы на местности Научно-исследовательская работа в группе Следопыт
Научно-исследовательская работа в группе Следопыт Цифровые данные. Цифровая технология. Цифровая революция
Цифровые данные. Цифровая технология. Цифровая революция Гипотезы возникновение жизни на Земле
Гипотезы возникновение жизни на Земле Кодирование и обработка графической информации
Кодирование и обработка графической информации Европейские нормативы теплозащиты зданий. Технологии теплозащиты и естественной вентиляции архитектурных сооружений в Казахстане
Европейские нормативы теплозащиты зданий. Технологии теплозащиты и естественной вентиляции архитектурных сооружений в Казахстане Вода
Вода Маленькие герои большой войны. Кто такие пионеры?
Маленькие герои большой войны. Кто такие пионеры? Таблица умножения для младших школьников (тренажер)
Таблица умножения для младших школьников (тренажер) Людовик ван Бетховен
Людовик ван Бетховен Моя театральная деятельность Диск
Моя театральная деятельность Диск Государства на политической карте мира
Государства на политической карте мира Благоустройство объекта Свиридовский пруд
Благоустройство объекта Свиридовский пруд Countable nouns
Countable nouns Опиливание заготовок из сортового проката
Опиливание заготовок из сортового проката Органическая архитектура
Органическая архитектура Уровень и качество жизни населения
Уровень и качество жизни населения Виды треугольников. Логическая задача
Виды треугольников. Логическая задача Затратный подход к оценке собственности
Затратный подход к оценке собственности Презентация Играем вместе
Презентация Играем вместе Михаил Лямин
Михаил Лямин Как стать личностью
Как стать личностью