Тест:
1. При стандартных условиях теплота образования равна 0 для:
а) водорода; б)
воды; в) пероксида водорода; г) оксида алюминия.
2. Реакция, уравнение которой N2 + O2 = 2NO – Q, относится к реакциям:
а) эндотермического соединения; б) экзотермического соединения;
в) эндотермического разложения; г) экзотермического разложения.
3. При взаимодействии 10 г натрия с водой выделяется 36,46 кДж теплоты. Какое количество теплоты (в кДж) выделилось, если в результате реакции образовалось 200 г гидроксида натрия?
а) 838; б) 209,5; в) 364,6; г) 419.
4. Даны теплоты реакций:
С + 1/2О2 = СО, Н=- 110 кДж, 2СО + О2 = 2СО2, Н=- 566 кДж.
Определить теплоту образования углекислого газа из простых веществ (в кДж/моль).
а) 346; б) 786; в) 503; г) 393.
5. Дано термохимическое уравнение:
2SO2 + O2 = 2SO3 + 198 кДж.
В результате реакции выделилось 495 кДж теплоты. Какая масса (в г) сернистого газа прореагировала с кислородом?
а) 160; б) 640; в) 320; г) 320.
Количество правильных ответов – ваша оценка









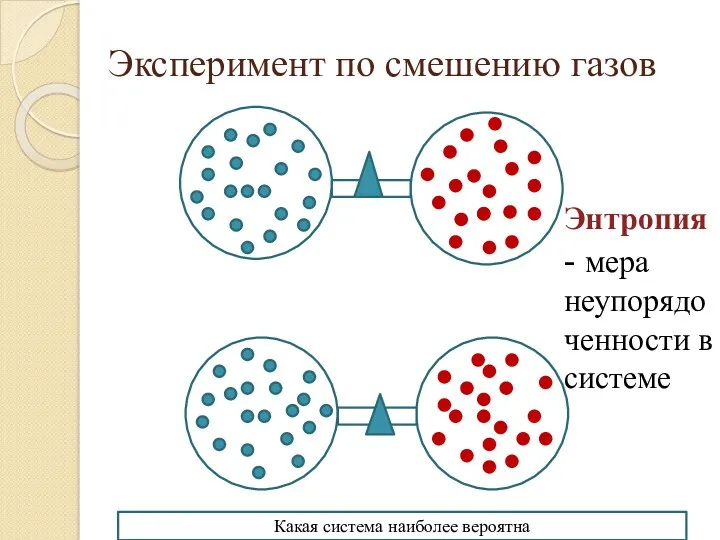



 Материнская смертность в Америке
Материнская смертность в Америке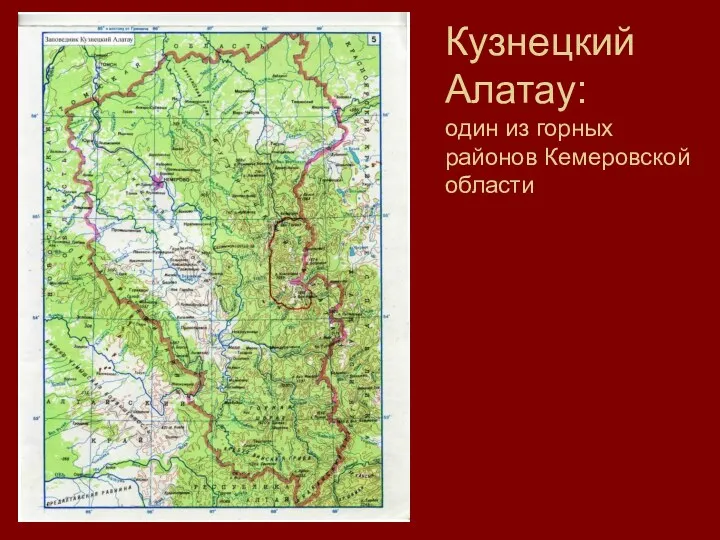 Презентация к занятию Кузнецкий Алатау
Презентация к занятию Кузнецкий Алатау В царстве грибов.
В царстве грибов. Способы и методика введения лекарственных средств детям
Способы и методика введения лекарственных средств детям Технологии продвижения на рынке СМИ
Технологии продвижения на рынке СМИ Сравнительный анализ деятельности таможенных союзов
Сравнительный анализ деятельности таможенных союзов Информация. Измерение информации
Информация. Измерение информации Феохромоцитома. Гиперальдостеронизм. Синдром Иценко-Кушинга
Феохромоцитома. Гиперальдостеронизм. Синдром Иценко-Кушинга Можно ли есть снег. Проект
Можно ли есть снег. Проект Основы православной культуры. 10 заповедей Божиих.
Основы православной культуры. 10 заповедей Божиих. Презентация к уроку: Времена года: лето, осень
Презентация к уроку: Времена года: лето, осень Ситуационный анализ рынка
Ситуационный анализ рынка Студенческая научная международная конференция
Студенческая научная международная конференция Базовые логические элементы ЭВМ
Базовые логические элементы ЭВМ Типы кристаллических структур. Вопросы для повторения.
Типы кристаллических структур. Вопросы для повторения. рельеф:скульптура поверхности
рельеф:скульптура поверхности Папье-маше. Поросёнок
Папье-маше. Поросёнок Белый медведь в Антарктиде
Белый медведь в Антарктиде Оформление рецептов
Оформление рецептов Jeopardy set 2
Jeopardy set 2 Методический семинар: Формирование познавательной учебной деятельности на уроках физики с применением технологии развития критического мышления
Методический семинар: Формирование познавательной учебной деятельности на уроках физики с применением технологии развития критического мышления Первая помощь при отравлениях
Первая помощь при отравлениях Строительные материалы
Строительные материалы Что может дизайн. Тема 1.2
Что может дизайн. Тема 1.2 Автоматизация теплового режима двухванного сталеплавильного агрегата
Автоматизация теплового режима двухванного сталеплавильного агрегата Дефекты соединений при сварке металлов и причины их возникновения
Дефекты соединений при сварке металлов и причины их возникновения Ковалева Н.В. СОШ №9
Ковалева Н.В. СОШ №9 Научные достижения. Инновации в гостиничном бизнесе
Научные достижения. Инновации в гостиничном бизнесе