Содержание
- 2. Цели урока: Дать представления о галогенах на основании их сравнительной характеристики; Рассмотреть простые вещества – галогены,
- 3. Проверка домашнего задания: тестирование выписать номера свойств и характеристик для (1 варианта) металлов, для (2 варианта)
- 4. Правильные ответы: для металлов характерно: Маленький радиус атомов Большой радиус атомов На внешнем уровне от 1
- 5. Правильные ответы: для неметаллов характерно: Маленький радиус атомов Большой радиус атомов На внешнем уровне от 1
- 6. Цепочка превращений: Н2 → NaH → Н2 → HCl NaOH H2 + 2Na = 2NaH NaH
- 7. Задача №2 стр. 93 Дано: Решение: V( возд.)=100 л V(O2)= V( возд.)* ᵠ (O2)= 100*0,21= ᵠ
- 8. Задача №3 стр.103 Дано: Решение: mтех.(WO3) =928 кг W(WO3) = 100%-25%=75% W(примес.) = 25% m (WO3)
- 9. Изучение нового материала: Положение в ПСХЭ и строение атомов: VII группа главная подгруппа
- 10. Общая характеристика галогенов: на внешнем уровне 7 электронов; увеличивается радиус атомов; ослабевают неметаллические свойства; окислительная способность
- 11. Галогены – простые вещества Фтор F2 – ядовитый газ светло- желтого цвета с резким раздражающим запахом.
- 18. Простые вещества -галогены 2. Хлор Cl2 – желто-зеленый газ с резким удушливым запахом
- 24. Простые вещества - галогены 3. Бром Br2 – жидкость бурого цвета со зловонным запахом
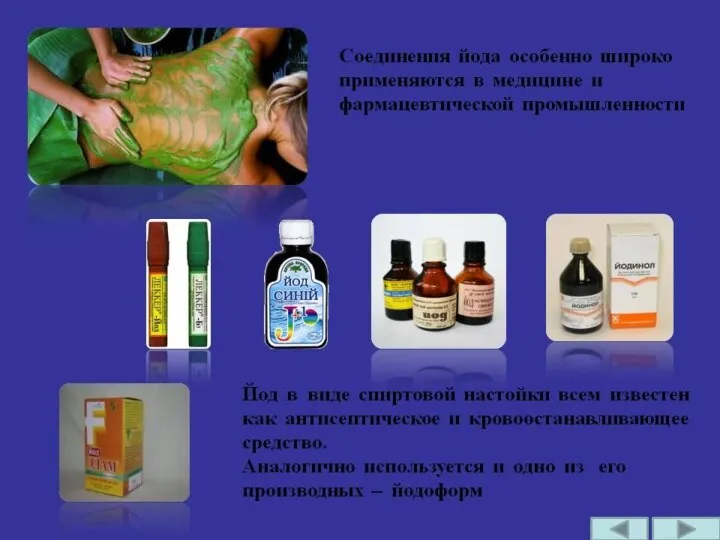
- 28. Простые вещества - галогены 4. Йод I2 – твердое вещество черно-серого цвета с металлическим блеском и
- 35. Химические свойства галогенов Взаимодействие с простыми веществами: а) с водородом Н2 Н2 + Г2 = 2НГ
- 36. Горение сурьмы в хлоре
- 37. Химические свойства галогенов 2. Взаимодействие со сложными веществами: а) с водой 2F2 + 2H2O = 4HF
- 44. Скачать презентацию








































 Мой дом
Мой дом Значение С.Р.И. в жизни дошкольника.
Значение С.Р.И. в жизни дошкольника. Единый государственный экзамен. Серия Я сдам ЕГЭ. Особенности и секреты подготовки пособием Я сдам ЕГЭ!
Единый государственный экзамен. Серия Я сдам ЕГЭ. Особенности и секреты подготовки пособием Я сдам ЕГЭ! Правописание частицы НЕ с глаголами
Правописание частицы НЕ с глаголами Книгопечатание в россии
Книгопечатание в россии Применение квантово-размерных систем. Структуры с вертикальным переносом
Применение квантово-размерных систем. Структуры с вертикальным переносом Обобщение знаний по темам Науки о природе. Методы изучения
Обобщение знаний по темам Науки о природе. Методы изучения Муниципальная программа Формирование современной городской среды в Новолялинском городском округе на 2018-2022 годы
Муниципальная программа Формирование современной городской среды в Новолялинском городском округе на 2018-2022 годы Религия. Роль религии в жизни общества (11 класс)
Религия. Роль религии в жизни общества (11 класс) Arduino робот своими руками
Arduino робот своими руками Православные иконы
Православные иконы Фармацевтическая экспертиза и таксировка рецептов
Фармацевтическая экспертиза и таксировка рецептов Соли
Соли Математика в моей профессии
Математика в моей профессии Полезные ископаемые
Полезные ископаемые Современные взгляды рациональной антибактериальной и антибиотикопрофилактической терапии беременных и кормящих женщин
Современные взгляды рациональной антибактериальной и антибиотикопрофилактической терапии беременных и кормящих женщин Родителем быть нелегко, но плохо, если нелегко от этого нашим детям.
Родителем быть нелегко, но плохо, если нелегко от этого нашим детям. Александр Сергеевич Даргомыжский
Александр Сергеевич Даргомыжский Урок вежливости
Урок вежливости Презентация к лекционному занятию Введение в предмет фармакология
Презентация к лекционному занятию Введение в предмет фармакология Вкурсе №5, май 2020
Вкурсе №5, май 2020 Аудиторское заключение
Аудиторское заключение Студенческая олимпиада: Я-профессионал
Студенческая олимпиада: Я-профессионал Неотложные состояния в акушерстве. Преэклампсия. Эклампсия
Неотложные состояния в акушерстве. Преэклампсия. Эклампсия Введение нового поколения ФГОС НПО и СПО
Введение нового поколения ФГОС НПО и СПО Моделирование как метод коррекции познавательной деятельности детей с интеллектуальной недостаточнсотью
Моделирование как метод коррекции познавательной деятельности детей с интеллектуальной недостаточнсотью Обогащение полезных ископаемых. Классификация дробилок. (Лекция 6)
Обогащение полезных ископаемых. Классификация дробилок. (Лекция 6) Ведущие причины смерти и их профилактика с помощью ЗОЖ
Ведущие причины смерти и их профилактика с помощью ЗОЖ