Содержание
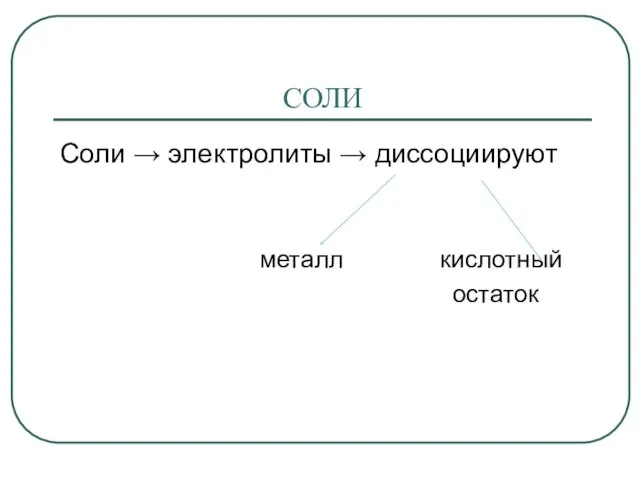
- 2. СОЛИ Соли → электролиты → диссоциируют металл кислотный остаток
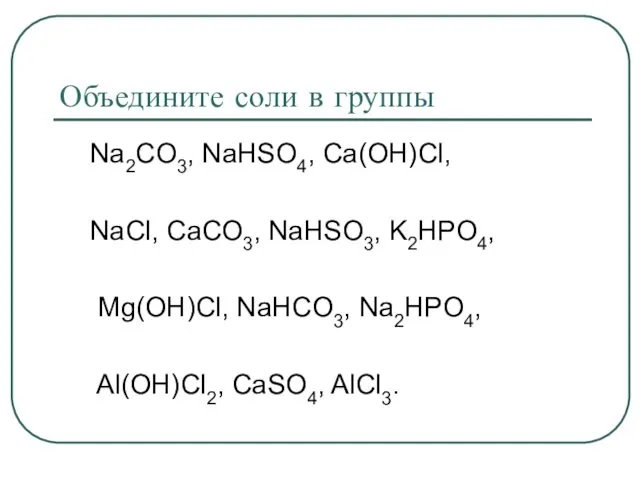
- 3. Объедините соли в группы Na2CO3, NaHSO4, Ca(OH)Cl, NaCl, CaCO3, NaHSO3, K2HPO4, Mg(OH)Cl, NaHCO3, Na2HPO4, Al(OH)Cl2, СаSO4,
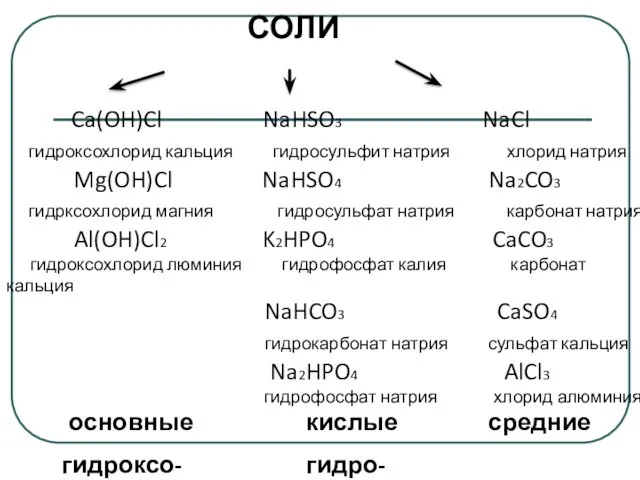
- 4. СОЛИ Ca(OH)Cl NaHSO3 NaCl гидроксохлорид кальция гидросульфит натрия хлорид натрия Mg(OH)Cl NaHSO4 Na2CO3 гидрксохлорид магния гидросульфат
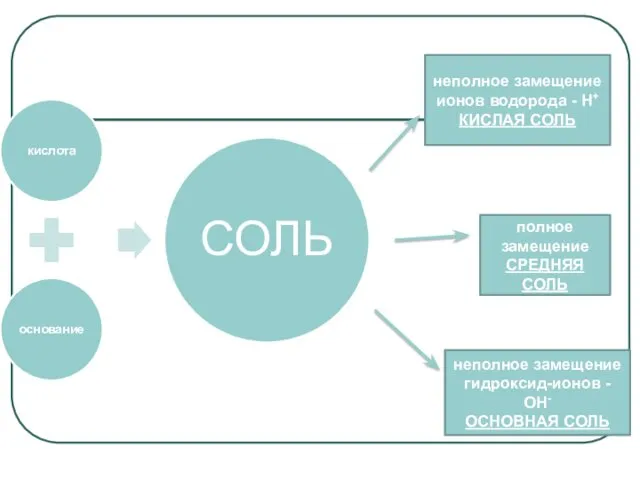
- 5. полное замещение СРЕДНЯЯ СОЛЬ неполное замещение ионов водорода - Н+ КИСЛАЯ СОЛЬ неполное замещение гидроксид-ионов -
- 6. Физические свойства Большинство солей твёрдые вещества белого цвета, некоторые соли окрашены: CuSO4 – голубой CuS –
- 7. Химические свойства 1. Взаимодействие с кислотами H2SO4 + BaCl2= BaSO4 ↓+ 2HCl Na2CO3 + 2HCl =
- 8. Химические свойства 2. Взаимодействие с основаниями FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl NH4Cl +KOH =
- 9. Химические свойства 3. Взаимодействие с солями BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
- 10. Химические свойства 4. Взаимодействие с металлами Mg + CuSO4 = MgSO4 + Cu
- 11. Получение солей КИСЛОТА + МЕТАЛЛ ОКСИД МЕТАЛЛА (ОСНОВНЫЙ, АМФОТЕРНЫЙ) + КИСЛОТА ГИДРОКСИД МЕТАЛЛА + КИСЛОТА ЩЕЛОЧЬ
- 12. Известняк СаСО3
- 14. Гипс СaSO4
- 18. Поваренная соль (хлорид натрия) в природе встречается как каменная соль, входит в состав морской воды. В
- 19. Сульфат железа (II) (железный купорос) FeSO4 · 7H2O. Применяется для борьбы с грибковыми заболеваниями, поражениями грибками
- 21. Скачать презентацию














 Времена года. Зима
Времена года. Зима Технология процессов каменной кладки
Технология процессов каменной кладки Лекция 5 . Теплотехнический расчет
Лекция 5 . Теплотехнический расчет Первая помощь при сотрясении головного мозга
Первая помощь при сотрясении головного мозга Самодельная мягкая игрушка-брелок
Самодельная мягкая игрушка-брелок Как же нам выполнить Великое Поручение?
Как же нам выполнить Великое Поручение? Коллоидные растворы
Коллоидные растворы Дидактическая игра Зимующие птицы
Дидактическая игра Зимующие птицы Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Почему Oriflame? Выбор сетевой компании
Почему Oriflame? Выбор сетевой компании Повышение качества образования через деятельность классного руководителя.
Повышение качества образования через деятельность классного руководителя. Презентация Кислород
Презентация Кислород Применение ГНКТ в нефтегазодобыче
Применение ГНКТ в нефтегазодобыче Дидактическая игра для детей 3-4 лет Помоги зайке
Дидактическая игра для детей 3-4 лет Помоги зайке Проект Работа над задачей
Проект Работа над задачей Новогодняя игра Поле чудес
Новогодняя игра Поле чудес Марк Матвеевич Антокольский (1843 - 1902)
Марк Матвеевич Антокольский (1843 - 1902) Выпускница детского дома
Выпускница детского дома III Национальный чемпионат по профессиональному мастерству среди инвалидов и лиц с ОВЗ Абилимпикс
III Национальный чемпионат по профессиональному мастерству среди инвалидов и лиц с ОВЗ Абилимпикс Гигиена крупного рогатого скота. Лекция 8
Гигиена крупного рогатого скота. Лекция 8 Работа с инструментом Перо
Работа с инструментом Перо Dünýä okeany. Dünýä okeany we onuň bölekleri
Dünýä okeany. Dünýä okeany we onuň bölekleri Движение задним ходом
Движение задним ходом Арифметикалық амалдар 6-сынып
Арифметикалық амалдар 6-сынып Устройства защитного отключения
Устройства защитного отключения Quiz. English language grade 5
Quiz. English language grade 5 Механика грунтов. Практические занятия
Механика грунтов. Практические занятия Приемы и техники формирования УУД на уроках в аспекте системно-деятельностного подхода
Приемы и техники формирования УУД на уроках в аспекте системно-деятельностного подхода