Пример: Взаимодействие хлорида бария с сульфатом натрия.
BaCl2 + Na2SO4 BaSO4
+ NaCl
Ba2+
2Cl-
+
+
2Na+
SO42-
+
1. Записать уравнение реакции в молекулярном виде.
Порядок действий:
2. Расставить коэффициенты.
2
3. По таблице растворимости, определить нерастворимые вещества. Обозначить их стрелкой вниз.
4. Составить полное ионное уравнение (растворимые вещества расписать на ионы.
BaSO4
+
2Na+
+
2Cl-
5. Сократить одинаковые ионы в левой и правой части полного ионного уравнения.
6. Составить сокращенное ионное уравнение.
Ba2+
+
SO42-
BaSO4








 Синодальный перевод Библии
Синодальный перевод Библии Языковые паттерны (предикаты)
Языковые паттерны (предикаты) My family traditions connected with holidays
My family traditions connected with holidays Классический преобразователь напряжения
Классический преобразователь напряжения Маркировка зарубежных полупроводниковых компонентов
Маркировка зарубежных полупроводниковых компонентов Движение вдоль линии с одним датчиком
Движение вдоль линии с одним датчиком Стратегия научно-технологического развития Российской Федерации
Стратегия научно-технологического развития Российской Федерации Учитель года 2015-2016
Учитель года 2015-2016 Презентация к занятию по внеурочной деятельности Многоцветные кружева родного края Алексеевский район
Презентация к занятию по внеурочной деятельности Многоцветные кружева родного края Алексеевский район Роль логистики в организации
Роль логистики в организации Четвериков Андрей
Четвериков Андрей Презентация Искусственные острова мира
Презентация Искусственные острова мира Масса. Плотность. Объем
Масса. Плотность. Объем Основы работы с Единой Информационной системой в сфере закупок
Основы работы с Единой Информационной системой в сфере закупок Основные урологические синдромы
Основные урологические синдромы Приложение №1 к уроку Природные зоны Русской равнины
Приложение №1 к уроку Природные зоны Русской равнины Суффикс как часть слова. Урок русского языка во 2 классе
Суффикс как часть слова. Урок русского языка во 2 классе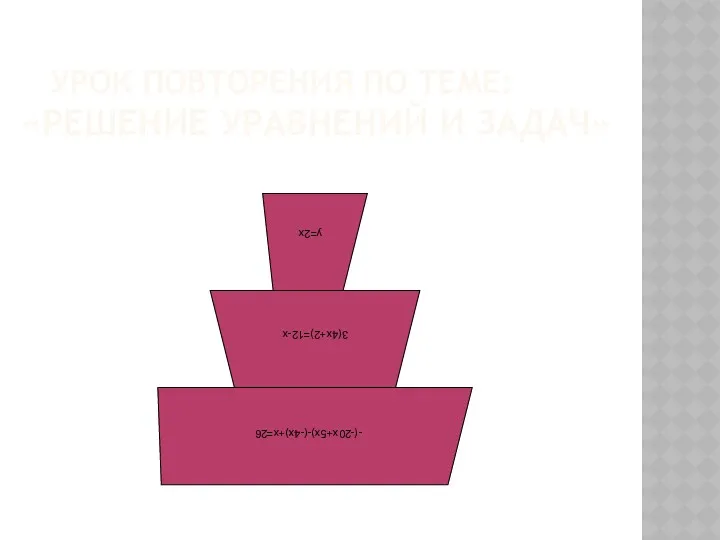 Презентация к открытому уроку по математике в 6 классе Тема Решение уравнений и задач
Презентация к открытому уроку по математике в 6 классе Тема Решение уравнений и задач Логосказка для малышей
Логосказка для малышей Патология. Общая и частная
Патология. Общая и частная Central Nervous System
Central Nervous System Необычное путешествие
Необычное путешествие Электрическая емкость. Конденсаторы
Электрическая емкость. Конденсаторы Конструкция скважины
Конструкция скважины Особенности производства сыров из козьего молока
Особенности производства сыров из козьего молока Попереднє очищення води методом вапнування
Попереднє очищення води методом вапнування Подготовка к экзаменам по русскому языку (8 класс)
Подготовка к экзаменам по русскому языку (8 класс) Русь в середине XI - начале XII века
Русь в середине XI - начале XII века