Содержание
- 2. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп.
- 3. Валентность гидроксогруппы – Количество гидроксогрупп определяется степенью окисления металла, образующего основание. Например:
- 4. Название оснований Гидроксид + Название металла в родительном падеже + Степень окисления римскими цифрами
- 5. Дайте названия гидроксидам NaOH Ca(OH)2 Fe(OH)2 Fe(OH)3 Al(OH)3 Гидроксид натрия Гидроксид железа (II) Гидроксид кальция Гидроксид
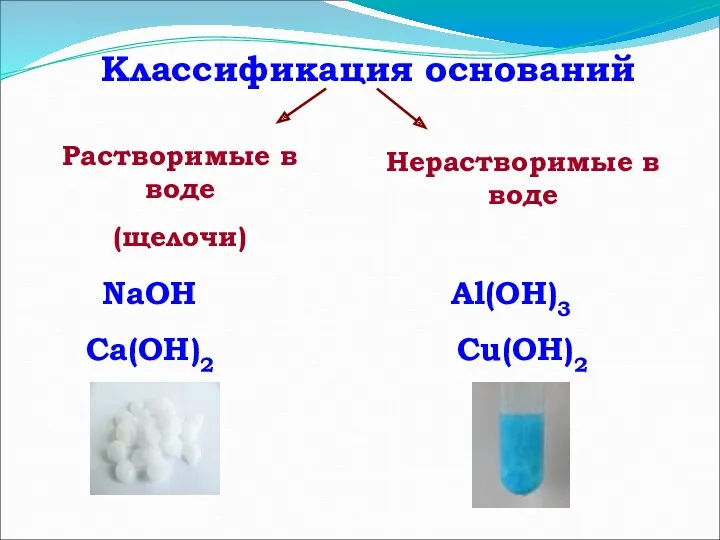
- 6. Классификация оснований Растворимые в воде (щелочи) Нерастворимые в воде NaOH Ca(OH)2 Al(OH)3 Сu(OH)2
- 7. Получение оснований и их свойства
- 8. Щелочи получают взаимодействием активных металлов с водой.
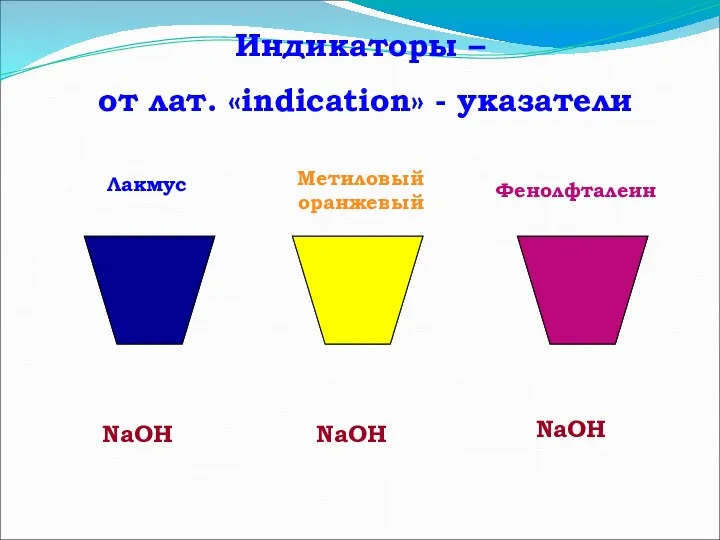
- 9. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус Метиловый оранжевый Фенолфталеин
- 10. Взаимодействие с индикаторами Помни! Нерастворимые основания не меняют окраску индикаторов.
- 11. Щёлочь + оксид неметалла → соль + вода ( реакция обмена) УСЛОВИЕ: оксиду неметалла должна соответствовать
- 12. Щелочь + соль → новое основание + новая соль ( реакция обмена) 3NaOH+FeCl3→Fe(OH)3↓+ 3NaCl Условия протекания
- 13. Получение и свойства нерастворимых оснований
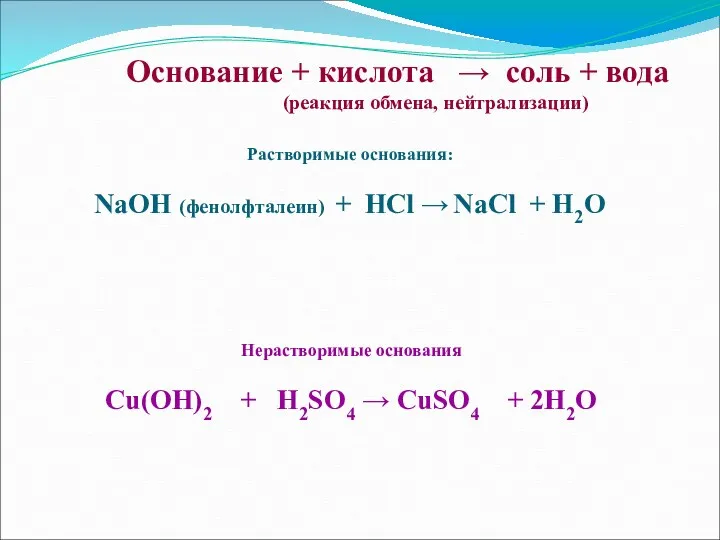
- 14. Основание + кислота → соль + вода (реакция обмена, нейтрализации) Растворимые основания: NaOH (фенолфталеин) + HCl
- 15. Лабораторная работа «Получение и химические свойства оснований» Цель: изучить химические свойства оснований. Оборудование и реактивы: штатив
- 16. Нерастворимое основание →оксид металла + вода (разложение при нагревании) Mg(OH)2 → MgO + H2O 2Fe(OH)3 →
- 17. Выполните задания 1 вариант Напишите уравнения реакции в трех видах: Na2CO3+Вa(OH)2= 2 вариант Напишите уравнения реакции
- 19. Скачать презентацию













 Презентация к уроки технологии в 3 классе Работа с тканью
Презентация к уроки технологии в 3 классе Работа с тканью Отражения. Принцип построения отражений
Отражения. Принцип построения отражений Классный час Мир моих увлечений 2-3 класс
Классный час Мир моих увлечений 2-3 класс Вавилонский царь Хаммурапи и его законы
Вавилонский царь Хаммурапи и его законы Социальное проектирование
Социальное проектирование هوش مصنوعی
هوش مصنوعی BL BOSCH 5.3 ABS. System Description of BL ABS
BL BOSCH 5.3 ABS. System Description of BL ABS Презентация подвиг во имя жизни
Презентация подвиг во имя жизни Презентация кружка Волшебные краски 2 часть
Презентация кружка Волшебные краски 2 часть Моделирование плечевого изделия с цельнокроеным рукавом. 6 класс
Моделирование плечевого изделия с цельнокроеным рукавом. 6 класс Сказочная страна (ИЗО)
Сказочная страна (ИЗО) Мы за здоровый образ жизни. Познавательный час
Мы за здоровый образ жизни. Познавательный час Создание функций из массива данных. Интерполяция. Регрессия. Прикладные методы расчета и программные комплексы (4)
Создание функций из массива данных. Интерполяция. Регрессия. Прикладные методы расчета и программные комплексы (4) Консультация для воспитателей Развитие фонематического слуха у детей дошкольного возраста
Консультация для воспитателей Развитие фонематического слуха у детей дошкольного возраста Архитектура персонального компьютера
Архитектура персонального компьютера Монтаж установки предварительной очистки ППФ. Монтаж установки очистки пропилена от каталитических ядов
Монтаж установки предварительной очистки ППФ. Монтаж установки очистки пропилена от каталитических ядов Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы
Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы Учимся рисовать ракету
Учимся рисовать ракету Многоатомные спирты
Многоатомные спирты Политико-правовые идеи Древней Греции
Политико-правовые идеи Древней Греции Фото
Фото Электротехнические комплексы
Электротехнические комплексы Общественное движение при Александре I
Общественное движение при Александре I Медиаторы нервной системы
Медиаторы нервной системы Нейрон. Его свойства и функции
Нейрон. Его свойства и функции Теоретические основы реструктуризации
Теоретические основы реструктуризации Кто говорит, что на войне не страшно, тот ничего не знает о войне. 9 мая - День Победы
Кто говорит, что на войне не страшно, тот ничего не знает о войне. 9 мая - День Победы Черная металлургия России. Изделия из чугуна и стали
Черная металлургия России. Изделия из чугуна и стали