Содержание
- 2. Водород. Химические свойства Водород взаимодействует с оксидами некоторых металлов: H2 + CuO = H2O + Cu
- 3. Водород. Химические свойства На свету: H2 + Cl2 = 2HCl(г) + 185 кДж Посмотрим схему реакции:
- 4. Водород. Химические свойства При реакции с простыми веществами образуются гидриды: 2Li + H2 = 2LIH (гидрид
- 5. Водород. Химические свойства Получение водорода. В промышленности. Электролиз водных растворов солей. 2H2O = H2 + O2
- 6. Водород. Химические свойства Получение водорода. В лаборатории. Получение водорода действием разбавленных кислот на металлы. Zn +
- 7. Водород. Химические свойства Применение водорода. Получение аммиак. Примерно 50% получаемого водорода используется для получения аммиака (NH3).
- 8. Соединения Основные соединения водорода и их названия: H2 молекулярный водород H2O – вода HCl – соляная
- 9. Вода. Расстворы Вода. Растворы. В воде растворяется большое количество веществ. Растворами называют однородны системы, состоящие из
- 10. Вода. Растворы. Если вещество при смешивании образует мутные смеси, они называются взвесями. Взвеси, в которых мелкие
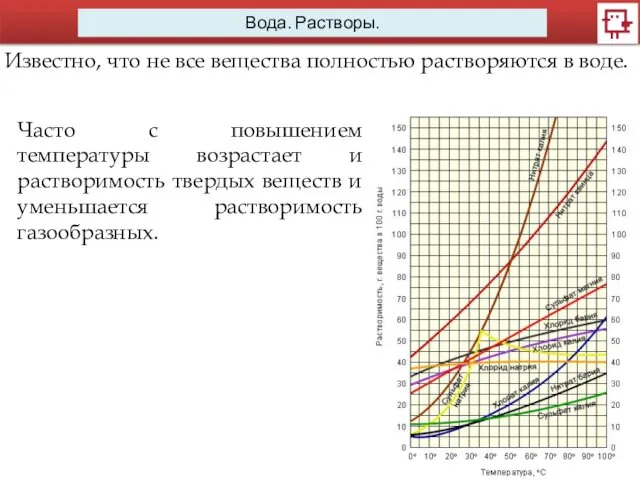
- 11. Вода. Растворы. Известно, что не все вещества полностью растворяются в воде. Часто с повышением температуры возрастает
- 12. Вода. Растворы. Насыщенные и ненасыщенные растворы. Раствор, в котором данное вещество при данной температуре больше не
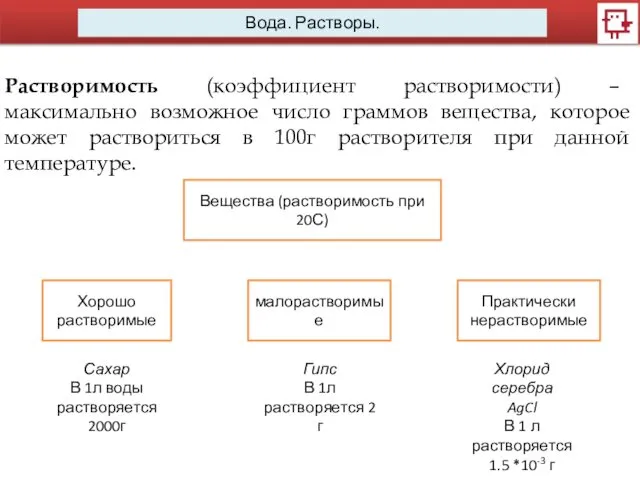
- 13. Вода. Растворы. Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может раствориться в 100г
- 14. Вода. Растворы. Определение массовой доли растворенного вещества. Отношение массы растворенного вещества к массе раствора называют массовой
- 15. Вода. Растворы. Пример. В 250г воды растворено 50г кристаллогидрата (FeSO4*7H2O). Вычислить массовую долю кристаллогидрата и безводного
- 17. Скачать презентацию












 Электромагнитные колебания и волны. Подготовка к ГИА
Электромагнитные колебания и волны. Подготовка к ГИА Планирование издержек и результатов производства
Планирование издержек и результатов производства Ограниченность экономических ресурсов и порождаемые ею проблемы
Ограниченность экономических ресурсов и порождаемые ею проблемы С днем рождения
С днем рождения Инфекционные и неинфекционные заболевания. Профилактика
Инфекционные и неинфекционные заболевания. Профилактика Мировая экономика. Международные экономические отношения
Мировая экономика. Международные экономические отношения Классикалык өркениет діндері (КӨД). Дәріс №4
Классикалык өркениет діндері (КӨД). Дәріс №4 Микрофлора различных продуктов питания
Микрофлора различных продуктов питания Защита отчетов по производственной технологической практике
Защита отчетов по производственной технологической практике Мастер - класс по теме: Исследовательский метод познания - путь к расширению географического образования
Мастер - класс по теме: Исследовательский метод познания - путь к расширению географического образования Развитие медицины сегодня, её роль в обществе. Современное состояние медицины в РК
Развитие медицины сегодня, её роль в обществе. Современное состояние медицины в РК Алекса́ндр Миха́йлович Бу́тлеров
Алекса́ндр Миха́йлович Бу́тлеров Технология изготовления и организация производства двутавровой балки
Технология изготовления и организация производства двутавровой балки Західноукраїнські землі, історичні персоналії (ХVІІІ - ХХ ст)
Західноукраїнські землі, історичні персоналії (ХVІІІ - ХХ ст) Условная функция в EXCEL. 9 класс
Условная функция в EXCEL. 9 класс Презентация ко дню матери Милая мама
Презентация ко дню матери Милая мама Безударные гласные -о-, -а- в корне слова. Тренажёр
Безударные гласные -о-, -а- в корне слова. Тренажёр Химическая организация клетки. Органические вещества клетки
Химическая организация клетки. Органические вещества клетки УРОК ЗАКРЕПЛЕНИЯ И ОБОБЩЕНИЯ ЗНАНИЙ ПО ТЕМЕ: III-I группы главные подгруппы
УРОК ЗАКРЕПЛЕНИЯ И ОБОБЩЕНИЯ ЗНАНИЙ ПО ТЕМЕ: III-I группы главные подгруппы Разработка технологического маршрута изготовления рамной конструкции
Разработка технологического маршрута изготовления рамной конструкции Организация риск-менеджмента на предприятии
Организация риск-менеджмента на предприятии Переработка нефти и газа. Транспорт нефти и газа
Переработка нефти и газа. Транспорт нефти и газа Равновесие рычага
Равновесие рычага Презентация Эмоции и мимика
Презентация Эмоции и мимика Хроническая венозная недостаточность нижних конечностей
Хроническая венозная недостаточность нижних конечностей Электронная физкультминутка для глаз
Электронная физкультминутка для глаз Ғимараттарды қайтадан құру жобалау жұмыстарының технологиясы
Ғимараттарды қайтадан құру жобалау жұмыстарының технологиясы Орест Адамович Кипренский (13 (24) марта 1782 - 12 (24) октября 1836) — русский художник, график и живописец, мастер портрета
Орест Адамович Кипренский (13 (24) марта 1782 - 12 (24) октября 1836) — русский художник, график и живописец, мастер портрета