Заключение
Существует большое количество промышленных и лабораторных способов получения водорода, так
как водород практически не встречается в чистой форме в природе.
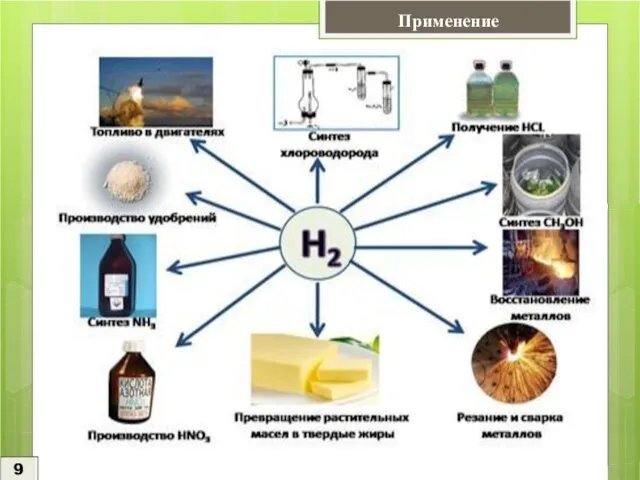
Водород применяется в различных отраслях промышленности: химической, пищевой, металлургической, авиационной, метеорологической, топливной и т.д.
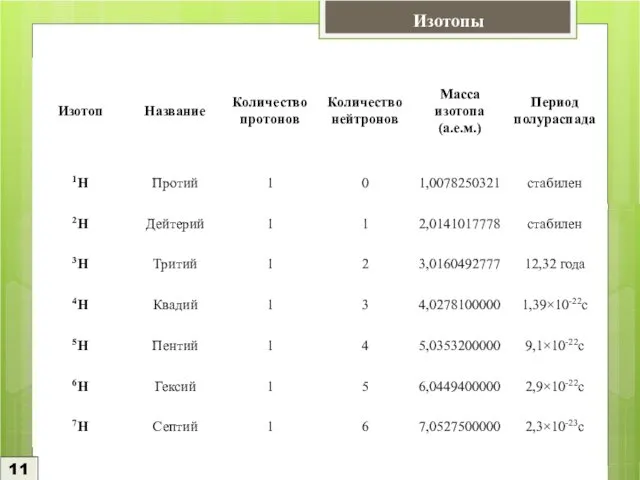
У водорода существует большое количество изотопов, но хорошо изучены из них лишь 3. Дейтерий и тритий являются спасением человечества от энергетического голода, т.к. в управляемых термоядерных процессах каждый литр природной воды будет давать столько же энергии, сколько ее дают сейчас 300 л бензина.
Водород – удивительный элемент. После его открытия удалость понять, как построены кислоты и основания - эти важнейшие классы химических соединений. Он стал незаменимым лабораторным реактивом – осаждал металлы из растворов солей, восстанавливал металлические окислы. Именно от водорода ведут ученые длинную цепочку превращений атомных ядер. Благодаря изучению водорода целый спектр наук получил возможность развиваться.
13







 Презентация Не дай себя в обиду!
Презентация Не дай себя в обиду! Дубровина Р.Ж. Урок СБО в 9 классе Сервировка праздничного стола, презентация
Дубровина Р.Ж. Урок СБО в 9 классе Сервировка праздничного стола, презентация Russian Federation
Russian Federation Effects of mesostructure on the in-plane properties of tufted carbon fabric composites
Effects of mesostructure on the in-plane properties of tufted carbon fabric composites Капитальный ремонт печи первичной метана
Капитальный ремонт печи первичной метана Парные согласные по звонкости и глухости
Парные согласные по звонкости и глухости Шаблоны презентаций Школьные
Шаблоны презентаций Школьные Рельеф России
Рельеф России Презентация: ата- аналар җыелышы
Презентация: ата- аналар җыелышы Технологии усиления оснований и фундаментов
Технологии усиления оснований и фундаментов Строительные материалы
Строительные материалы Классный час Семья.Семейные ценности
Классный час Семья.Семейные ценности Способы решения квадратных уравнений
Способы решения квадратных уравнений Строительно-монтажные работы при замене лифтового оборудования
Строительно-монтажные работы при замене лифтового оборудования Етилен і ацетилен – ненасичені вуглеводні
Етилен і ацетилен – ненасичені вуглеводні Галилео Галилей
Галилео Галилей Анализ разработки объекта ЮВ1(1) Северо-Варьеганского месторождения
Анализ разработки объекта ЮВ1(1) Северо-Варьеганского месторождения Святая царская семья
Святая царская семья Взаимное расположение прямых и плоскостей в пространстве
Взаимное расположение прямых и плоскостей в пространстве Презентация Три сойки
Презентация Три сойки музеи
музеи Сочинение по картине А.Н. Комарова Наводнение
Сочинение по картине А.Н. Комарова Наводнение конспект занятия я не песчинка, я - планета!
конспект занятия я не песчинка, я - планета! Ближний и Средний Восток. ХХ век
Ближний и Средний Восток. ХХ век Праздник осени
Праздник осени Сценарий классного часа Александр Невский - лицо России
Сценарий классного часа Александр Невский - лицо России Психоэмоциональное напряжение как фактор риска соматических заболеваний детей в условиях Арктического региона
Психоэмоциональное напряжение как фактор риска соматических заболеваний детей в условиях Арктического региона Понятие филэмбриогенезов. Практическая значимость для врача
Понятие филэмбриогенезов. Практическая значимость для врача