Слайд 2
Периодический закон, периодическая система
Период: закономерности изменения металлических (неметаллических) свойств, валентности (степени окисления), радиуса
атомов, свойств оксидов, гидроксидов
Группа: закономерности изменения металлических (неметаллических) свойств, валентности (степени окисления), радиуса атомов

Слайд 3
Периодический закон, периодическая система
Чем определяются свойства элемента?
В чем физический смысл периодического закона?
Элементы какого
семейства стоят в начале периода? В конце периода?
Назовите группы сходных элементов (семейства)?
Характеристика химического элемента по ПСХЭ по плану

Слайд 4
Периодический закон, периодическая система
1. Свойства простых веществ, а также формы и свойства их
соединений элементов находятся в периодической зависимости от заряда ядра атома

Слайд 5
Атомный номер элемента( физический смысл)
Атомный номер элемента показывает заряд ядра элемента, число протонов,
число электронов

Слайд 6
Номер периода
Номер периода показывает число электронных оболочек

Слайд 7
Номер группы
Номер группы показывает количество электронов на внешней оболочке

Слайд 8
Свойства элемента
Свойства элемента определяются
- зарядом ядра его атомов
- атомным радиусом
- числом электронов
на внешней оболочке

Слайд 9
Физический смысл периодического закона
Периодическое изменение свойств химических элементов и их соединений при увеличении
заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов
Примеры: группа I- ns1
группа II- ns2
группа III- ns2p1

Слайд 10
Закономерности изменения свойств атомов химических элементов

Слайд 11
Характеристика элемента по плану
Символ элемента (металл, неметалл, переходный элемент)
Положение в таблице: период, группа,
подгруппа
Строение атома: заряд ядра, количество протонов, нейтронов, электронов
Распределение электронов по электронным оболочкам
Типичные соединения: оксиды, гидроксиды (характер), летучие водородные соединения для неметаллов

Слайд 12
Характеристика элемента по плану
Валентность элемента
Сравнение металлических (неметаллических) свойств элемента с соседними элементами в
периоде и подгруппе.
Уравнения реакций, характеризующие свойства оксидов, гидроксидов элемента

Слайд 13
Характеристика магния
Mg – металл
3 период, II группа, главная подгруппа (А-подгруппа)
Заряд ядра Z=+12, число
протонов р = 12, число электронов е=12, число нейтронов n=12
Высшая валентность II
Типичные соединения
Оксид MgO – основной, Mg(OH)2 – основание

Слайд 14
Характеристика магния
Сравнение свойств:
период: Na MgAl металлические свойства уменьшаются
Группа: Be металлические свойства
Mg
увеличиваются Ca
Химические свойства типичных соединений
MgO + 2HNO3 = Mg(NO3)2 + H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O

Слайд 15
Характеристика фосфора
P – неметалл
3 период, V группа, главная подгруппа (А-подгруппа)
Заряд ядра Z=+15,
число протонов 1р= 15, число электронов е=15, число нейтронов 0n=16
Высшая валентность V
Оксид P2O5–кислотный, H3PO4– кислота, PH3- летучее водородное соединение















 Жизнь и творчество Василия Макаровича Шукшина
Жизнь и творчество Василия Макаровича Шукшина Функции мышления. Классификация мышления. Объект и субъект мышления
Функции мышления. Классификация мышления. Объект и субъект мышления Основные понятия: формы самостоятельных занятий, мотивация выбора
Основные понятия: формы самостоятельных занятий, мотивация выбора Информационные системы и базы данных
Информационные системы и базы данных Дмитрий Сергеевич Лихачев
Дмитрий Сергеевич Лихачев Oil and gas industry. Drilling rig and hoisting system
Oil and gas industry. Drilling rig and hoisting system Портфолио воспитателя
Портфолио воспитателя prezentatstia_sergeev_sergey_oput18
prezentatstia_sergeev_sergey_oput18 Связь координат. Продолжение
Связь координат. Продолжение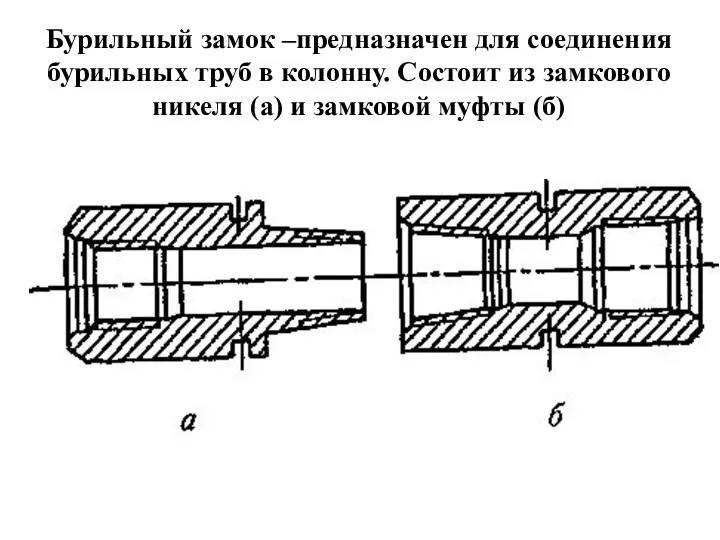 Оснастка бурильной колонны
Оснастка бурильной колонны домашнее задание по теме Дыхание
домашнее задание по теме Дыхание Popov_Mikhail
Popov_Mikhail Амарант в сельском хозяйстве
Амарант в сельском хозяйстве Валы и оси
Валы и оси Передача и воспроизведения ТВ изображений
Передача и воспроизведения ТВ изображений Инфекционные заболевания и их классификация
Инфекционные заболевания и их классификация Наглядные формы представления информации
Наглядные формы представления информации Создание графических изображений. Обработка графической информации. (7 класс)
Создание графических изображений. Обработка графической информации. (7 класс) Понятие о машине и механизме
Понятие о машине и механизме История связей с общественностью и рекламы
История связей с общественностью и рекламы Построение работы предприятия
Построение работы предприятия Senstone's overview
Senstone's overview Основы проектирования строительных конструкций
Основы проектирования строительных конструкций Описание опыта учителя географии
Описание опыта учителя географии Персональный компьютер
Персональный компьютер Бизнес-план агентства по организации романтических торжеств
Бизнес-план агентства по организации романтических торжеств Урок геометрии в 7 классе по теме Взаимное расположение графиков линейных функций.
Урок геометрии в 7 классе по теме Взаимное расположение графиков линейных функций. Литературный портал в городе N
Литературный портал в городе N