Содержание
- 2. Сегодня мы с вами должны вспомнить, чем отличаются жидкости от газов, и узнать, почему вода бывает
- 3. Давайте вспомним: 1.Основной закон, описывающий состояние газов называют законом _______. 2.Один моль любого газа занимает объём
- 4. Проверьте друг друга. 1.Авогадро, 2.22,4 л/моль, 3.Азот, кислород, 4.Озон, 5.Водород, 6.Известняка, 7.Синюю. За каждый правильный ответ
- 5. Попробуй реши: 1 вариант. Задача №1. Какой объём ( при н.у.) будут занимать 2 моль углекислого
- 6. Сверьте ответы… 1 Вариант Задача №1. Ответ: 44,8 л (1 Б) Задача №2. Ответ:661,8 л.(2Б) 2
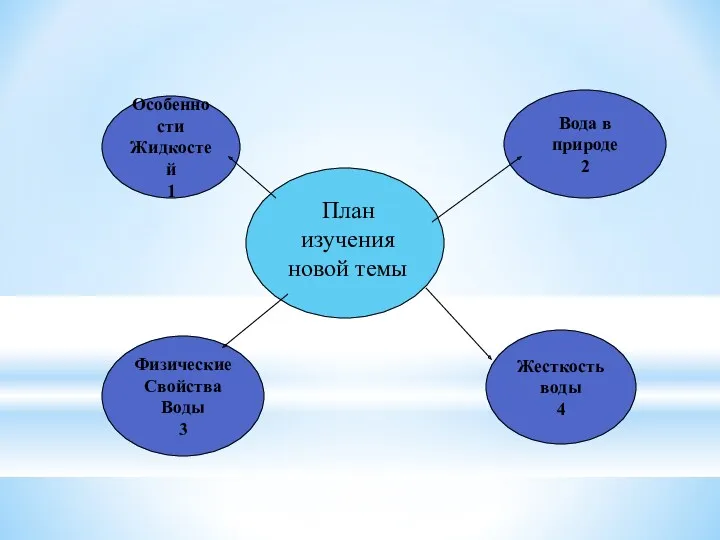
- 7. План изучения новой темы Физические Свойства Воды 3 Особенности Жидкостей 1 Жесткость воды 4 Вода в
- 8. Особенности жидкого состояния вещества. 1.Молекулы находятся непосредственно друг возле друга, поэтому жидкости – мало сжимаемы, в
- 9. Вода в природе. Важнейшим жидким веществом является вода, которая покрывает 2/3 поверхности Земли. 97,2 % общего
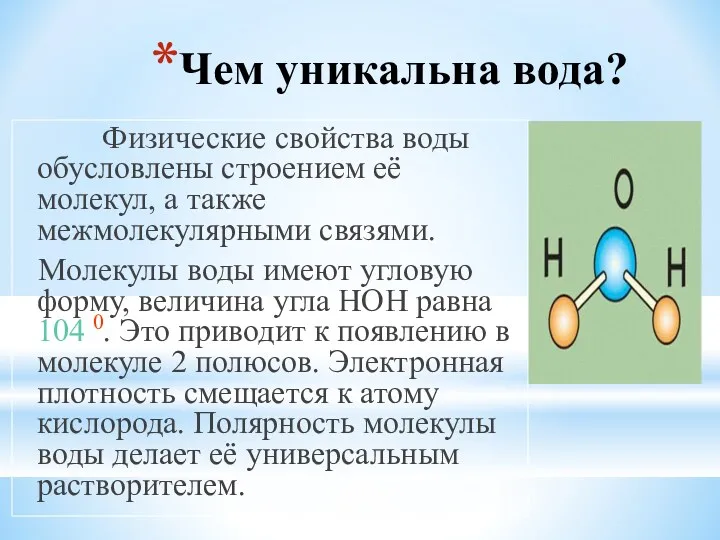
- 10. Чем уникальна вода? Физические свойства воды обусловлены строением её молекул, а также межмолекулярными связями. Молекулы воды
- 11. Вода имеет аномально высокую температуру плавления и кипения. Сравните молекулярные массы воды и других гидридов элементов
- 12. Ещё одна аномалия воды: Лёд благодаря водо- родным связям имеет ячеистое строение и поэтому легче воды.
- 13. Бывает ли вода «жесткой»? Жесткость природных вод может меняться в зависимости от года: она понижается зимой,
- 14. Виды жесткости. Общая жесткость состоит из временной и постоянной жесткости. Временная( устранимая)- карбонатная жесткость. Постоянная жесткость
- 15. ВИДЫ ЖЕСТКОСТИ. КАРБОНАТНАЯ жесткость зависит от содержания в воде гидрокарбонатов кальция и магния Са(НСО3)2, Mg(HCO3)2. Некарбонатная
- 16. Что такое «жесткая» вода? Жесткая вода- это накипь на деталях бытовой техники , стенках котлов и
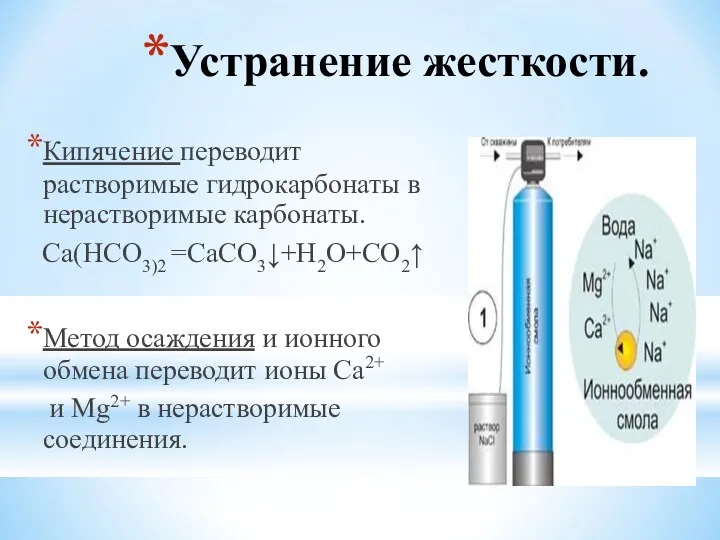
- 17. Устранение жесткости. Кипячение переводит растворимые гидрокарбонаты в нерастворимые карбонаты. Са(НСО3)2 =СаСО3↓+Н2О+СО2↑ Метод осаждения и ионного обмена
- 18. В минеральной воде содержатся растворенные соли, микроэлементы, а также некоторые биологически активные компоненты.
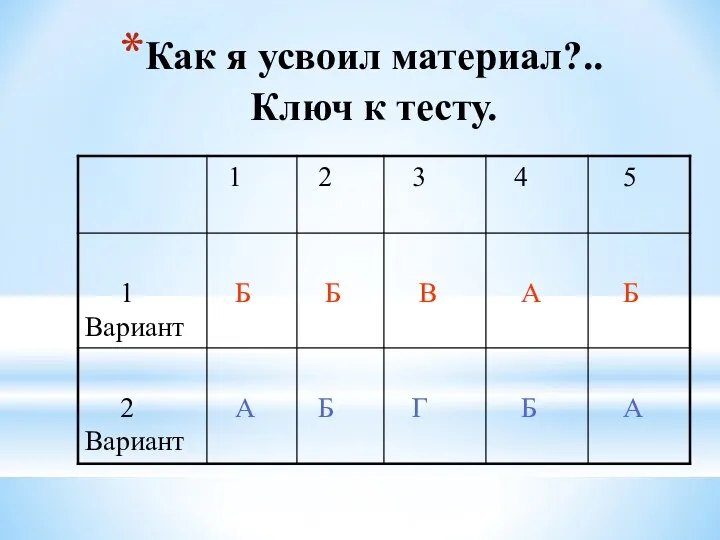
- 19. Как я усвоил материал?.. Ключ к тесту.
- 20. Подведем итоги. Подсчитайте свои баллы (каждый правильный ответ теста- 1балл) Поставьте себе оценку: 13-12 баллов- «пять»
- 21. Если Вы получили: «5» - § 9, №11, кроссворд; «4» - § 9, № 7,10; «3»
- 23. Скачать презентацию
















 Основы цветного ТВ
Основы цветного ТВ Достопримечательности Удмуртии
Достопримечательности Удмуртии Экспертиза лекарственных средств
Экспертиза лекарственных средств Power production
Power production Сложение и вычитание дробей
Сложение и вычитание дробей Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение
Оксиды. Классификация. Номенклатура. Физические и химические свойства. Получение. Применение Презентация урока-исследования Байкал-уникальное творение природы
Презентация урока-исследования Байкал-уникальное творение природы Guía para saber cómo subir un vídeo de Vidiomas a YouTube
Guía para saber cómo subir un vídeo de Vidiomas a YouTube Тихий Дон – казачья слава ( к 115-летию со дня рождения Михаила Александровича Шолохова)
Тихий Дон – казачья слава ( к 115-летию со дня рождения Михаила Александровича Шолохова) Индивидуальнодифференцированный подход в обучении как средство гуманизации образования. Концепция профильного обучения
Индивидуальнодифференцированный подход в обучении как средство гуманизации образования. Концепция профильного обучения Краудсорсинг, как инновация для реализации проектов по развитию городской среды
Краудсорсинг, как инновация для реализации проектов по развитию городской среды Болезнь Реклингхаузена
Болезнь Реклингхаузена Презентация рабочей программы по ОБЖ для детей старшего дошкольного возраста
Презентация рабочей программы по ОБЖ для детей старшего дошкольного возраста Услуги по управлению многоквартирным домом
Услуги по управлению многоквартирным домом Презентация Знакомство с решётками нашего города
Презентация Знакомство с решётками нашего города Родословное древо. Шарова Юлия
Родословное древо. Шарова Юлия Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Санкт-Петербургская филармония
Санкт-Петербургская филармония Смешанное и искусственное вскармливание. Гипогалактия. Лечебные смеси. Прикорм
Смешанное и искусственное вскармливание. Гипогалактия. Лечебные смеси. Прикорм macbook
macbook шаблон презентации Блокнот
шаблон презентации Блокнот Социальные сети: влияние на бренд,
Социальные сети: влияние на бренд, Из опыта работы (презентация) Отчет классного руководителя
Из опыта работы (презентация) Отчет классного руководителя Игрушки для развития мелкой моторики
Игрушки для развития мелкой моторики Государственное агентство автомобильных дорог Укравтодор
Государственное агентство автомобильных дорог Укравтодор Звание Народной… (к 115-летию со дня рождения К. И. Шульженко)
Звание Народной… (к 115-летию со дня рождения К. И. Шульженко) Учитель года 2015-2016
Учитель года 2015-2016 Презентация Времена года
Презентация Времена года