Содержание
- 2. Биологическая химия это фундамент современной медицины !
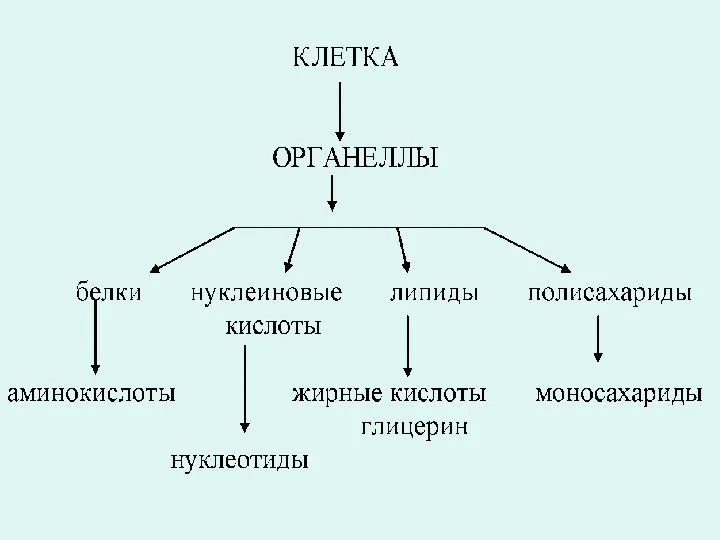
- 4. Биохимия изучает клеточные, субклеточные, надмолекулярные и молекулярные процессы, лежащие в основе развития и функционирования живых организмов,
- 5. Все свойства живых систем имеют материальную основу, которая, формируется и функционирует благодаря структурной организации химических соединений
- 7. Все свойства живого организма: структурная организация , обмен веществ, рост, развитие, многообразие видов, способность извлекать и
- 8. Белки "Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, и
- 9. Любая белковая молекула обладает уникальной способностью - узнавать определенную молекулу и избирательно взаимодействовать с ней. Это
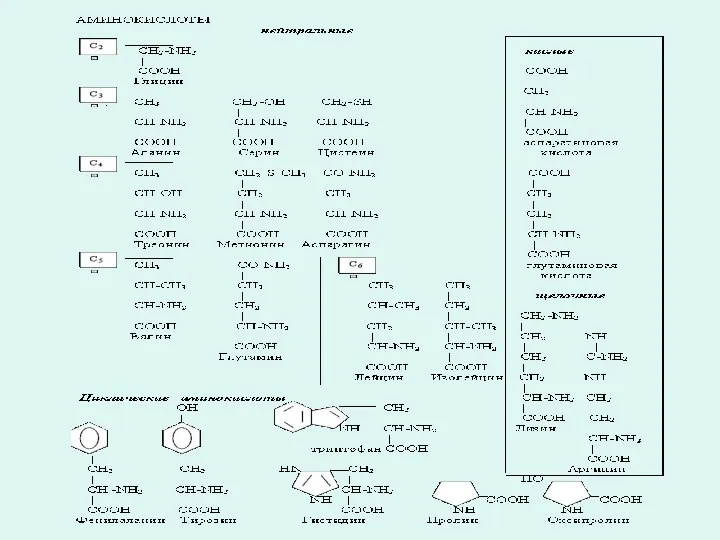
- 10. В составе белков обнаружено 20 аминокислот и ряд их производных: алифатические аминокислоты, ароматические аминокислоты, оксиаминокислоты, серосодержащие
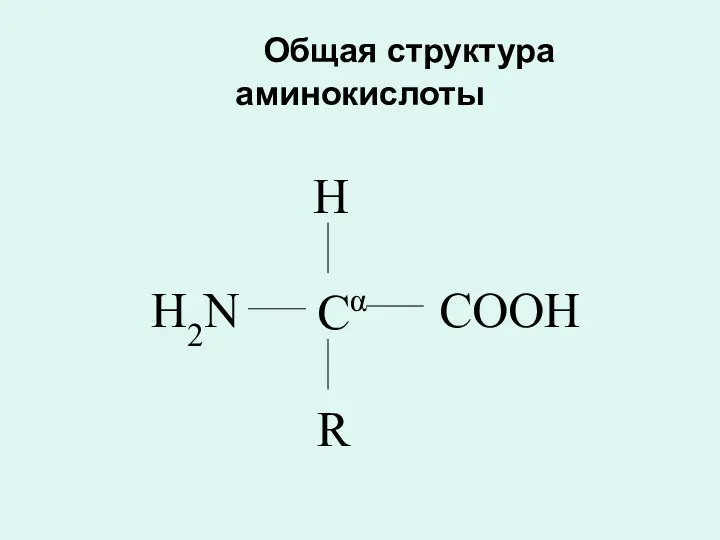
- 12. Общая структура аминокислоты Cα H R COOH H2N
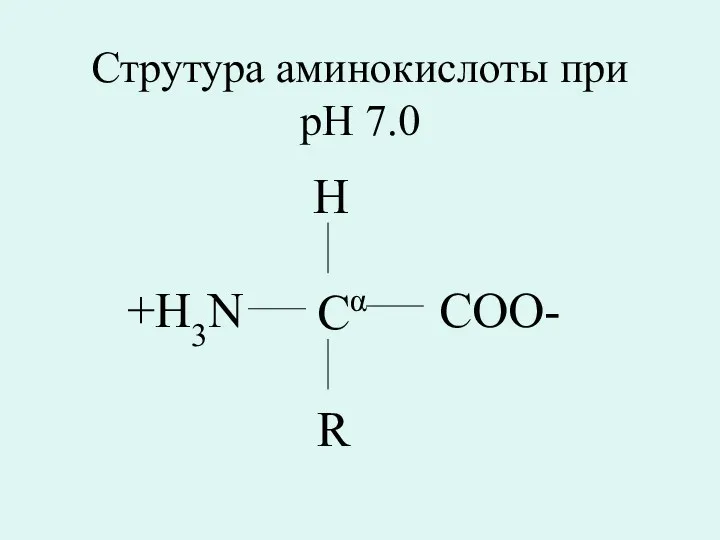
- 13. Струтура аминокислоты при pH 7.0 Cα H R COO- +H3N
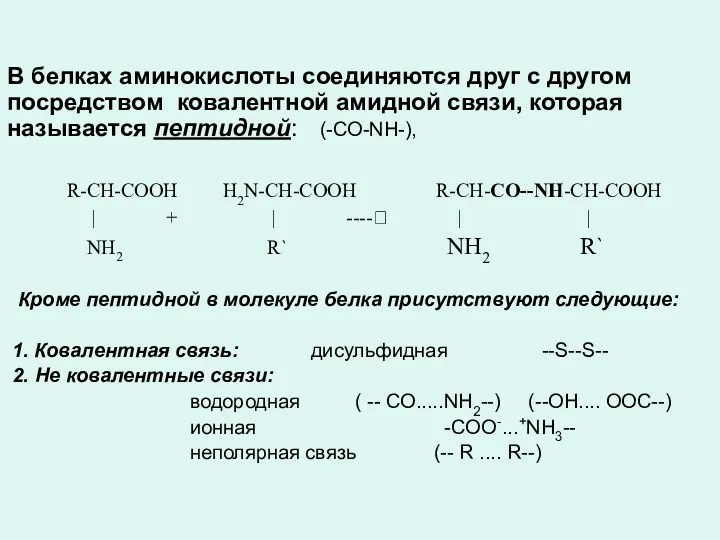
- 14. В белках аминокислоты соединяются друг с другом посредством ковалентной амидной связи, которая называется пептидной: (-СО-NH-), R-CH-COOH
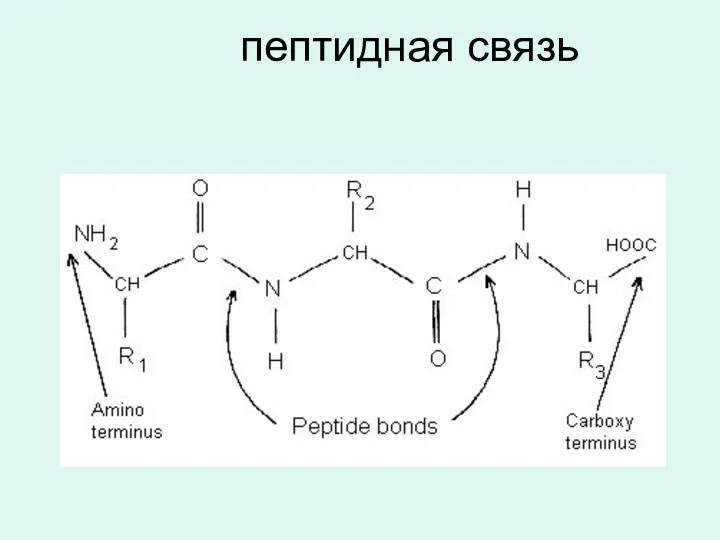
- 15. пептидная связь
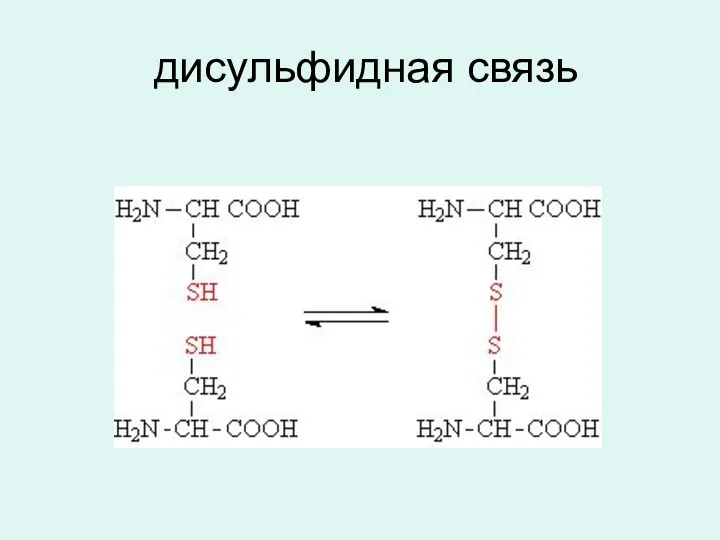
- 16. дисульфидная связь
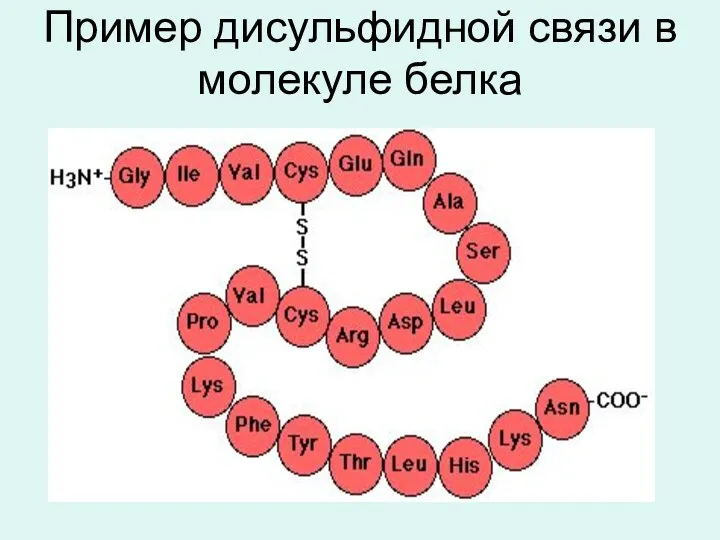
- 17. Пример дисульфидной связи в молекуле белка
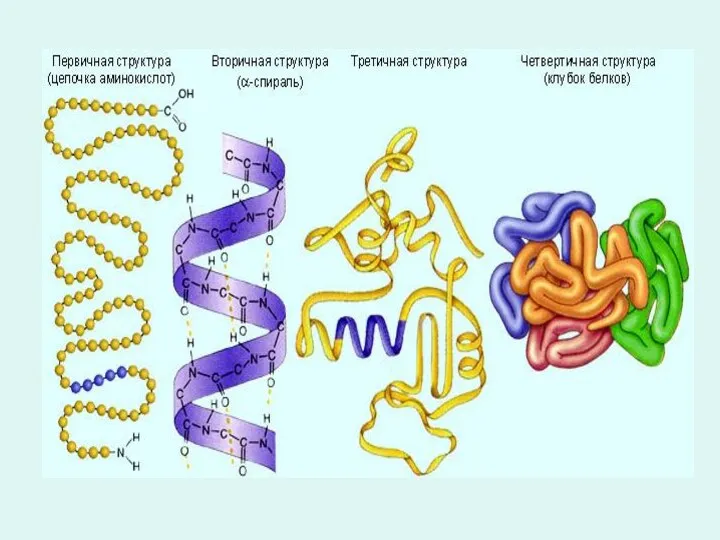
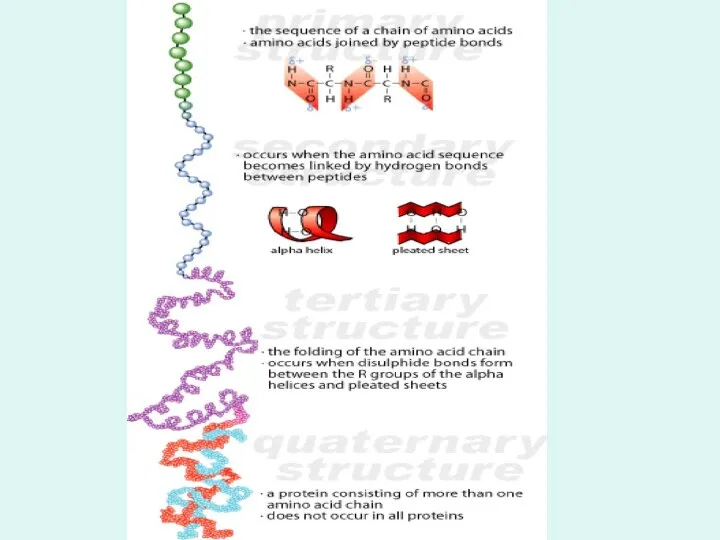
- 18. Первичная структура Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом пептидными
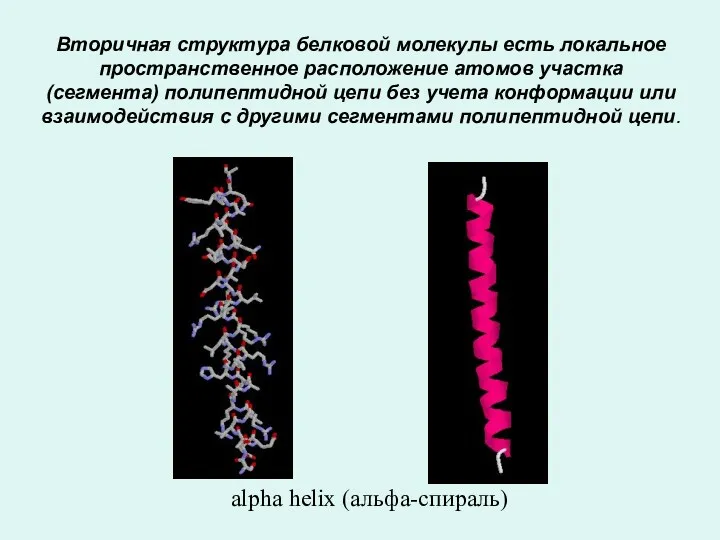
- 19. Вторичная структура белковой молекулы есть локальное пространственное расположение атомов участка (сегмента) полипептидной цепи без учета конформации
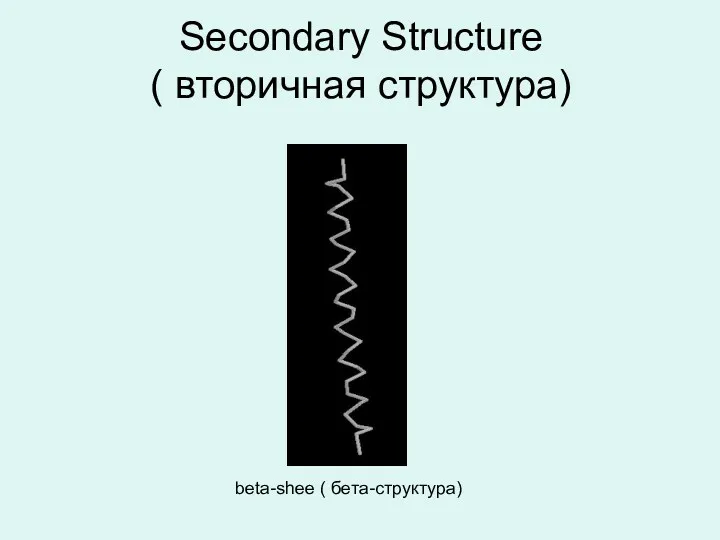
- 20. Secondary Structure ( вторичная структура) beta-shee ( бета-структура)
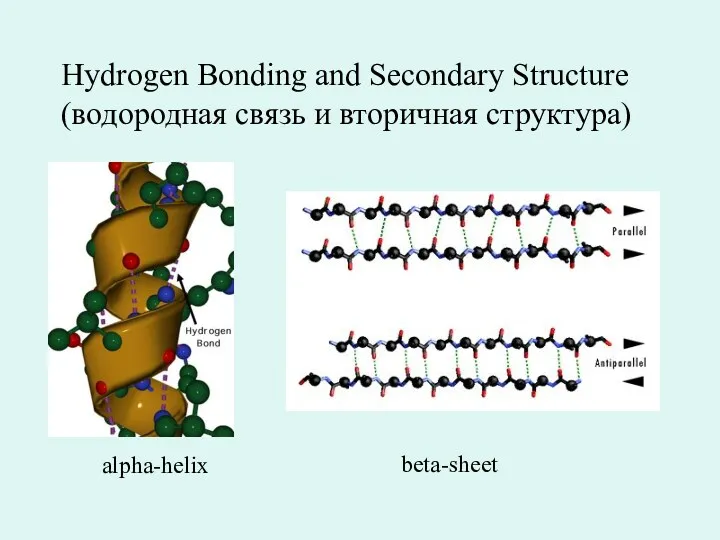
- 21. Hydrogen Bonding аnd Secondary Structure (водородная связь и вторичная структура) alpha-helix beta-sheet
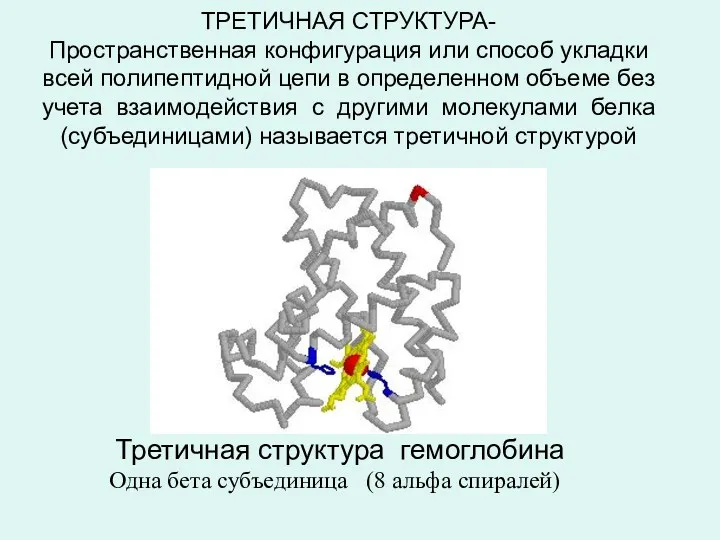
- 22. ТРЕТИЧНАЯ СТРУКТУРА- Пространственная конфигурация или способ укладки всей полипептидной цепи в определенном объеме без учета взаимодействия
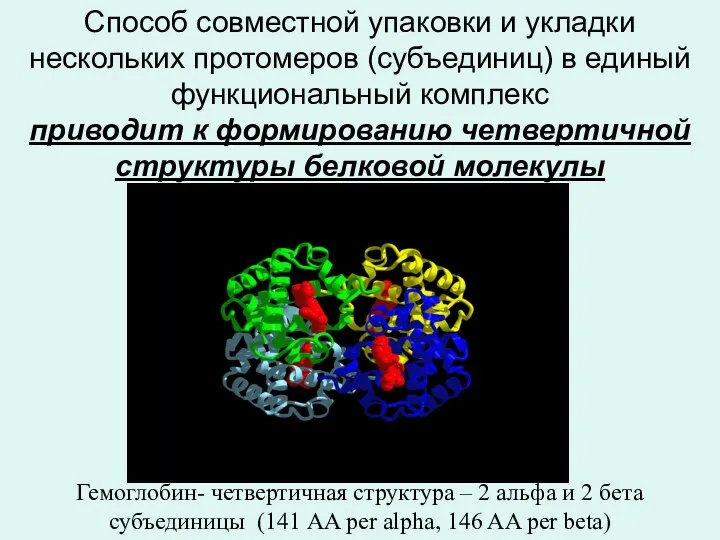
- 23. Способ совместной упаковки и укладки нескольких протомеров (субъединиц) в единый функциональный комплекс приводит к формированию четвертичной
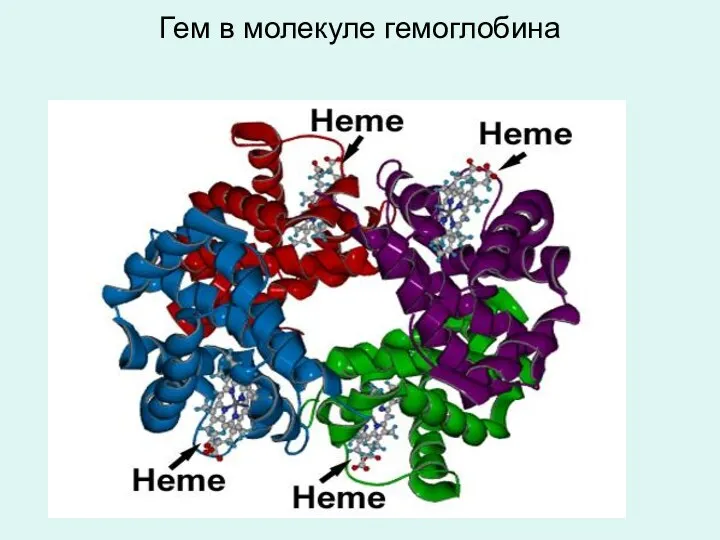
- 26. Гем в молекуле гемоглобина
- 27. Классификация белков. Простые белки 1.Протамины и гистоны - это обширная группа белков щелочного характера, поскольку в
- 28. Простые белки 3.Протеиноиды или склеропротеины это не растворимые в воде белки опорных тканей. Они почти не
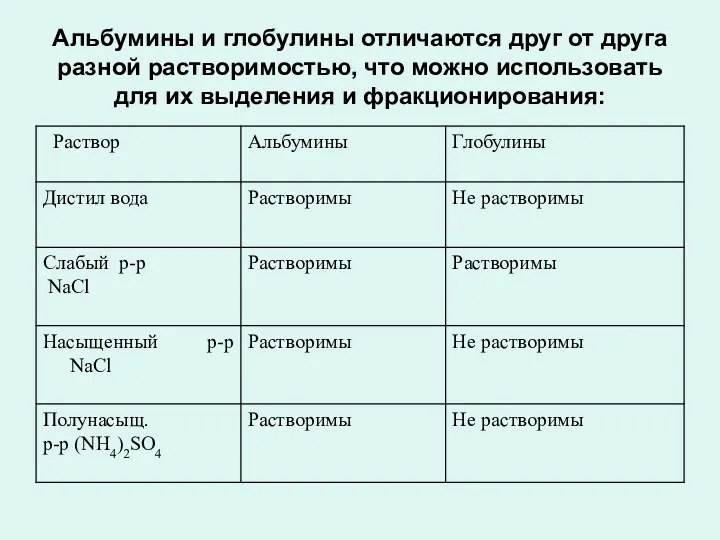
- 29. Альбумины и глобулины отличаются друг от друга разной растворимостью, что можно использовать для их выделения и
- 30. Сложные белки 1.Фосфопротеиды состоят из простого белка и простетической группы представленной радикалом фосфорной кислоты, присоединенной к
- 31. Сложные белки 2.Хромопротеиды , простетическая группа представлена различными окрашенными соединениями. К этой группе белков относится гемоглобин,
- 32. 3.Нуклеопротеиды - простетическая группа представлена нуклеиновыми кислотами. Различают два типа нуклеопротеидов: дезоксирибонуклеопротеиды, простетическая группа которых представлена
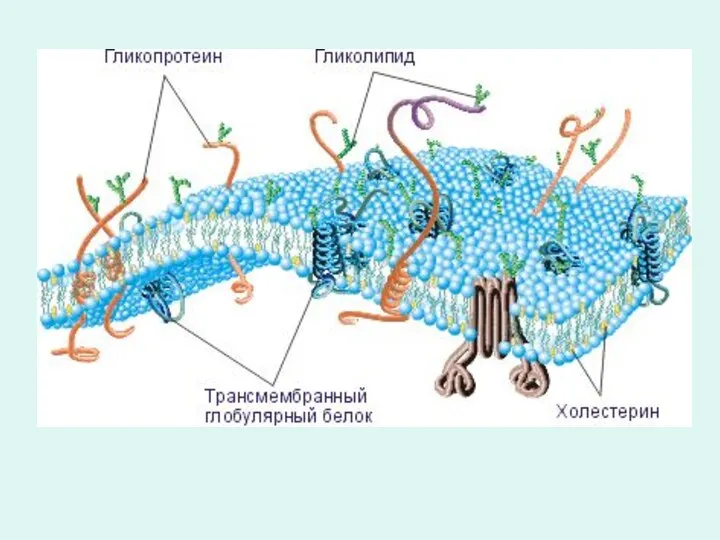
- 33. 4.Липопротеиды (протеолипиды) представляют комплексы белков и жироподобными соединениями, структура которых крайне неустойчива. Липопротеиды принимают участие в
- 34. 5.Глюкопротеиды различают две разновидности: - гликопротеиды и - протеогликаны (мукопротеиды). - Гликопротеиды это белки, простетическая группа
- 35. -Протеогликаны (гликопротеиды) представлены муцинами и мукоидами. К муцинам относятся муцин слюны и муцины слизистой желудочно-кишечного тракта.
- 36. 6. Металлопротеиды - белки, в состав которых входят металлы. К этой группе относится трансферрин, ферритин -
- 37. По биологическим функциям все белки можно объединить в следующие группы 1.Транспортные белки: гемоглобин, трансферрин, альбумины сыворотки
- 39. Белковая молекула любого типа в нативном состоянии обладает характерной для нее пространственной структурой - конформацией. В
- 40. У глобулярных белков – полипептидные цепи плотно свернуты в компактные сферические или глобулярные структуры. Они хорошо
- 41. Физико-химические свойства белков большая молекулярная масса, ионизация, гидратация растворимость белков осаждение
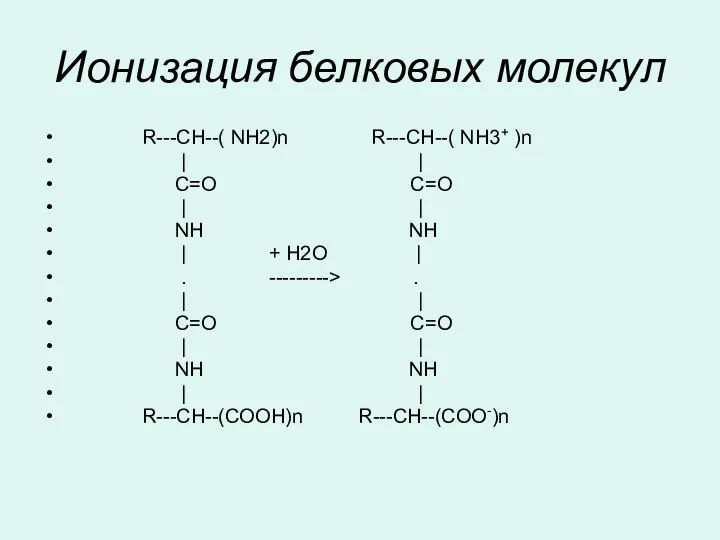
- 42. Ионизация белковых молекул R---CH--( NH2)n R---CH--( NH3+ )n | | C=O C=O | | NH NH
- 43. Ионизация белковых молекул зависит от рН срезы. При определенном значении рН число положительно и отрицательно заряженных
- 44. Пепсин имеет рI = 1, сальмин рI=12, альбумины рI=7. Изоэлектрическая точка большинства белков лежит в слабокислой
- 45. Величина ионизации белковой молекулы влияет на их подвижность в электрическом поле, что используется для электрофоретического разделения
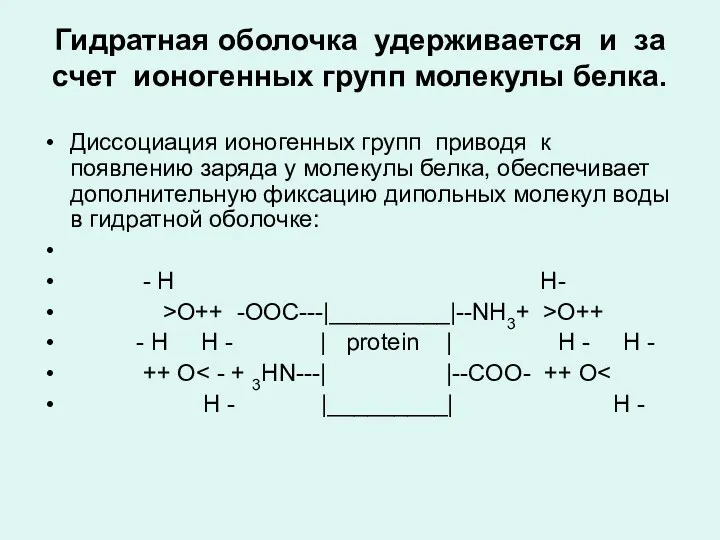
- 46. Гидратная оболочка удерживается и за счет ионогенных групп молекулы белка. Диссоциация ионогенных групп приводя к появлению
- 47. Осаждение белков из растворов При добавлении к раствору белка любых воду отнимающих средств (спирт, ацетон и
- 48. Обратимое осаждение (высаливание) Обратимое осаждение можно вызвать ацетоном, спиртом или растворами нейтральных солей (NaCl, MgSO4 KCl
- 49. Необратимое осаждение Необратимое осаждение, вызывается физическими факторами : нагревание, облучение, чередование замораживания и оттаивания и химическими
- 50. Цветные реакции на белки Белки в тканях или биологических жидкостях можно обнаружить с помощью цветных реакций
- 52. Скачать презентацию





























 Химический состав клетки
Химический состав клетки Животные Севера
Животные Севера Семечки: вред или польза
Семечки: вред или польза Свійські тварини
Свійські тварини Жұмыр құрттар
Жұмыр құрттар Лесные обитатели зимой
Лесные обитатели зимой Индивидуальное развитие организмов. Биогенетический закон
Индивидуальное развитие организмов. Биогенетический закон Строение и жизнедеятельность бактерий. 5 класс
Строение и жизнедеятельность бактерий. 5 класс Биотические факторы среды. Отношения организмов
Биотические факторы среды. Отношения организмов Формы естественного отбора
Формы естественного отбора Різноманітність водоростей
Різноманітність водоростей Вітаміни. Характеристика вітамінів
Вітаміни. Характеристика вітамінів Структурная организация белка
Структурная организация белка Презентация к уроку на тему Стебель.
Презентация к уроку на тему Стебель. Физиология сна и сновидений
Физиология сна и сновидений Семейство Бобовые - Fabaceae
Семейство Бобовые - Fabaceae Класс Брюхоногие моллюски
Класс Брюхоногие моллюски Презентация к уроку биологии в 8 классе по теме История развития знаний о строении и функциях организма человека
Презентация к уроку биологии в 8 классе по теме История развития знаний о строении и функциях организма человека Огляд відділів хромофітових водоростей (Stramenopiles)
Огляд відділів хромофітових водоростей (Stramenopiles) Пищеварительная система
Пищеварительная система Экзотические животные Лемуры
Экзотические животные Лемуры Липидтің пероксидті тотығуы. Антиоксиданттар
Липидтің пероксидті тотығуы. Антиоксиданттар Вегетативные органы растений: корень
Вегетативные органы растений: корень Строение цветка
Строение цветка Обмін речовин і енергії
Обмін речовин і енергії Электронный задачник. Часть 1. Содержание (Моногибридное скрещивание)
Электронный задачник. Часть 1. Содержание (Моногибридное скрещивание) Хищные растения
Хищные растения Тип простейшие. Одноклеточные организмы
Тип простейшие. Одноклеточные организмы